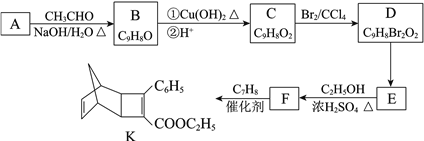
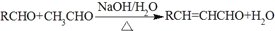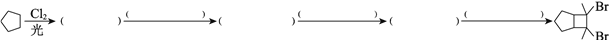-
科学技术的发展不仅改善了人们的生活,也帮助人类实现“上九天揽月、下五洋采‘冰’”。下列没有涉及化学反应的是
A.陶器烧制
B.粮食酿醋
C.开采得到可燃冰
D.发射火箭




A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列说法不正确的是
A. 漂白粉和医用酒精均可用作消毒剂
B. 聚乙烯塑料用作食品包装材料,会造成环境污染
C. 防晒是为防止强紫外线引起皮肤蛋白质被灼伤变性
D. 硅胶、生石灰、还原铁粉,均可用于防止食品被氧化而变质
难度: 中等查看答案及解析
-
室温下,向10 mL pH=3的CH3COOH溶液中加入下列物质,对所得溶液的分析正确的是
加入的物质
对所得溶液的分析
A
90 mLH2O
由水电离出的c(H+)=10-10 mol·L-1
B
0.1 mol CH3COONa固体
c(OH-)比原CH3COOH溶液中的大
C
10 mL pH=1 的H2SO4溶液
CH3COOH的电离程度不变
D
10 mL pH=11的NaOH溶液
c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
褪黑素是一种诱导自然睡眠的体内激素,可由色氨酸转化得到。

下列说法不正确的是
A. 色氨酸的化学式是C12H10N2O2
B. 色氨酸可发生缩聚反应
C. 褪黑素可发生水解反应
D. 褪黑素和色氨酸均可与KMnO4酸性溶液反应
难度: 中等查看答案及解析
-
研究金属腐蚀及防护的装置如图所示。

下列有关说法不正确的是
A. 图1:a点溶液变红
B. 图1:a点的铁比b点的铁腐蚀严重
C. 图2:若d为锌,则铁不易被腐蚀
D. 图2:正极的电极反应式为O2+4e- +2H2O =4OH-
难度: 中等查看答案及解析
-
向铜屑、稀盐酸和铁盐的混合溶液中持续通入空气可制备氯化铜。其反应过程如图所示。

下列说法不正确的是
A. Fe3+对该反应有催化作用
B. 该过程中的Fe3+可由Fe(NO3)3提供
C. 可用K3[Fe(CN)6]溶液区分Fe3+与Fe2+
D. 制备CuCl2的总反应为2Cu + O2 + 4HCl = 2CuCl2 + 2H2O
难度: 中等查看答案及解析
-
用如图所示装置进行气体x的性质实验,得出的实验结论正确的是
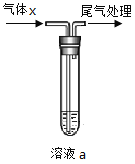
选项
实验操作
实验现象
实验结论
制备气体x
溶液a
A
乙醇与浓硫酸共热至170℃
KMnO4酸性溶液
紫色褪去
C2H4被氧化
B
碳酸钠与醋酸溶液作用
Na2SiO3溶液
产生白色沉淀
H2CO3的酸性强于H2SiO3
C
双氧水与二氧化锰作用
KI淀粉溶液
溶液变蓝
O2能将I-氧化为I2
D
溴乙烷与氢氧化钠醇溶液共热
Br2的四氯化碳溶液
橙红色褪去
C2H4与Br2发生加成反应
A. A B. B C. C D. D
难度: 中等查看答案及解析