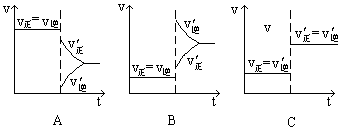-
现在探索、开发的新能源有:( )等
①核能 ②柴草 ③煤炭 ④太阳能 ⑤氢能 ⑥液化石油气 ⑦水煤气 ⑧天然气
A、①④⑤ B、②③⑥⑦ C、③⑥⑦⑧ D 、①②④
难度: 简单查看答案及解析
-
下列关于物质的分类中,均正确的是
A.Cu丝——电解质;氢氧化钾——电解质
B.二氧化硫——电解质;氧化钙——电解质
C.NaCl溶液——非电解质;酒精——非电解质
D.氧气——不属于电解质或非电解质;熔融的MgCl2——电解质
难度: 简单查看答案及解析
-
已知:C(s)+CO2(g)
2CO(g);DH>0。该反应达到平衡后,下列条件有利于反应向正方向进行的是
A.升高温度和减小压强 B.降低温度和减小压强
C.降低温度和增大压强 D.升高温度和增大压强
难度: 简单查看答案及解析
-
常温下,盐酸与氨水混合,所得溶液pH=7,则此溶液中的关系正确是
A.c(NH4+)<c(Cl-) B.c(NH4+)=c(Cl-)
C.c(NH4+)>c(Cl-) D.无法确定c(NH4+)与c(Cl-)
难度: 简单查看答案及解析
-
下列事实,不能用勒夏特列原理解释的是( )
A.溴水中有平衡:Br2+ H2O
HBr+ HBrO 加入 AgNO3溶液后,溶液颜色变浅
B.对CO(g) + NO2 (g)
CO2 (g)+ NO(g) 平衡体系增大压强可使颜色变深
C.升高温度能够增大硝酸钾在水中的溶解度
D.合成 NH3反应,为提高 NH3的产率,理论上应采取相对较低温度的措施
难度: 简单查看答案及解析
-
在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的有( )
A. 使pH试纸呈红色的溶液:Fe2+、NO3-、SO42-、Na+
B. pH值为1的溶液:Cu2+、Na+、Mg2+、NO3-
C. 水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+
D. 在加入铝粉放出氢气的溶液: Na+、Cl-、NH4+、NO3
难度: 简单查看答案及解析
-
已知“凡气体分子总数增多的反应一定是熵增大的反应”。根据所学知识判断,下列反应中,在所有温度下都不自发进行的
A.2O3(g) === 3O2(g) △H<0
B.2CO(g) === 2C(s)+O2(g) △H>0
C.N2(g) + 3H2(g) === 2NH3(g) △H<0
D.CaCO3(s) === CaO(s) + CO2(g) △H>0
难度: 简单查看答案及解析
-
在一定温度下的密闭容器中, 能表示 A(s)+2B(g)
C(g)+D(g) 已达到平衡状态的是( )
①混合气体的压强,②混合气体的密度,③B的物质的量浓度,④气体的总物质的量,⑤混合气体的平均相对分子质量,⑥v(C)与v(D)的比值
A. ①②③ B. ②③④⑥ C.②③⑤ D.①③④⑤
难度: 简单查看答案及解析
-
在相同温度时,100mL0.01mol•L-1的醋酸溶液与10mL 0.1mol•L-1的醋酸溶液相比较,下列数值中,前者大于后者的是( )
A. H+的物质的量 B. 醋酸的电离常数
C. 中和时所需NaOH的量 D. CH3COOH的物质的量
难度: 简单查看答案及解析
-
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:下列描述正确的是( )
A .反应开始到10 s,用Z表示的反应速率为0.158 mol/(L·s)
B.反应开始到10 s,X的物质的量浓度减少了0.79 mol/L
C.反应开始到10 s时,Y的转化率为79.0%
D.反应的化学方程式为:X(g)+Y(g)=Z(g)
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.25℃时,PH=3的CH3COOH溶液加水稀释10倍后,PH=4
B.25℃时,PH=11的NaOH溶液加水稀释100倍后,PH=9
C.25℃时,PH=3的CH3COOH溶液与PH=11的NaOH溶液等体积混合后,PH=7
D.90℃时,纯水的PH=6.2,所以加热可以使水呈酸性
难度: 简单查看答案及解析
-
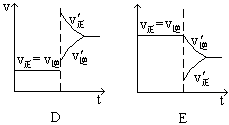
在一定温度不同压强(P1<P2)下,可逆反应2X(g)
2Y(g) + Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是
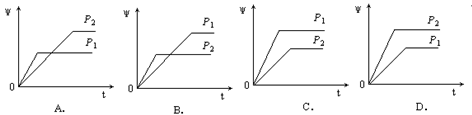
难度: 简单查看答案及解析
-
在25℃时,分别用pH=9、pH=10的两种氨水中和同浓度、同体积的盐酸,消耗氨水的体积分别为V1和V2,则V1和V2的关系是( )
A.V1=10V2 B.V1>10V2 C.V1<10V2 D.V2>10V1
难度: 简单查看答案及解析
-
用pH试纸测定溶液pH的正确操作是( )
A. 将一小块试纸放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,再与标准比色卡对照
B. 将一小块试纸用蒸馏水润湿后放在表面皿上,用玻璃棒蘸取少量待测点在试纸上,再与标准比色卡对照
C. 将一小条试纸在待测液中蘸一下,取出后放在表面皿上,与标准比色卡对照
D. 将一小条试纸先用蒸馏水润湿后,在待测液中蘸一下,取出后与标准比色卡
难度: 简单查看答案及解析
-
常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现分别进行下列两个实验:
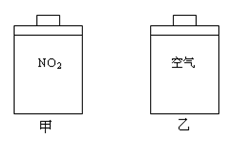
(N2O4
2NO2 △H > 0)
(a)将两容器置于沸水中加热
(b)在活塞上都加2 kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,
正确的是 ( )
A.(a)甲>乙 B.(b)甲>乙
C.(a)甲<乙 D.(b)甲=乙
难度: 简单查看答案及解析
-
反应A2+B2
2AB;在温度和压强可变条件下。产物AB的生成情况如图所示:a为500℃,b为300℃时情况,c为300℃ 时从时间t3开始向容器中加压的情况,则下列叙述正确的是
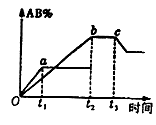
A.AB为气体,A2、B2中必有一种为非气体;正反应吸热
B.AB为气体,A2、B2中必有一种为非气体;正反应放热
C.AB为固体,A2、B2中必有一种为非气体;正反应放热
D.A2、B2、AB均为气体;正反应吸热
难度: 简单查看答案及解析