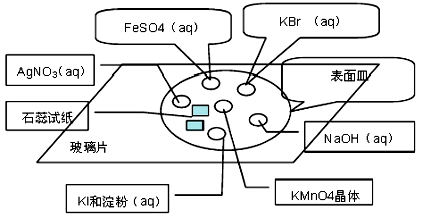
-
在隔绝空气的情况下,9.2g铁、镁、铝混合物溶解在一定量某浓度的稀硝酸中,当金属完全溶解后收集到4.48L(标准状况下)NO气体.在反应后的溶液中加入足量的烧碱溶液,可生成氢氧化物沉淀的质量为
A.18.6 g B.20 g C.19.4 g D.24 g
难度: 简单查看答案及解析
-
下列关于化学与生产、生活的认识错误的是
A.CO2、SO2、N2等均是造成温室效应的气体
B.节能减排符合低碳经济的要求
C.使用清洁能源是防止酸雨发生的重要措施之一
D.大量焚烧田间秸秆会污染空气
难度: 简单查看答案及解析
-
速滑冰刀可用不锈钢制成,不锈钢含有的主要元素是
A.铁 B.碳 C.铜 D.铝
难度: 简单查看答案及解析
-
下列关于物质用途的叙述中不正确的是
A.Na2O2可用作呼吸面具中的供氧剂
B.在常温下可用铝制容器贮藏运输浓硫酸
C.Al(OH)3可作治疗胃酸过多的一种药剂
D.四氧化三铁俗称铁红,可用于作油漆、红色涂料
难度: 中等查看答案及解析
-
下列关于氧化钠和过氧化钠的叙述正确的是
A.Na2O2和Na2O都是白色固体,都能与冷水作用得到O2和NaOH
B.在Na2O2与水的反应中,氧化剂是Na2O2,还原剂是水
C.相同物质的量的氧化钠和过氧化钠中阴离子物质的量之比为1:1
D.Na2O与Na2O2都能与水反应生成碱,它们都是碱性氧化物
难度: 中等查看答案及解析
-
下列离子方程式的书写正确的是
A.实验室用大理石和稀盐酸制取CO2:2H+ + CO32- = CO2↑+ H2O
B.NaHCO3溶液与NaOH溶液反应: OH- + HCO3- = CO32- + H2O
C.向AlCl3溶液中加入过量的NaOH溶液:Al3+ + 3OH- = Al(OH)3↓
D.钠和冷水反应 Na+2H2O=Na++2OH-+H2↑
难度: 中等查看答案及解析
-
在无色强酸性溶液中,下列各组离子能够大量共存的是
A.K+、Ca2+、Cl-、SO42- B.NH4+、HCO3-、Cl-、K+
C.Cl -、Na+、NO3-、Ca2+ D.Fe2+、NO3-、 I-、 Cl-
难度: 中等查看答案及解析
-
下列物质属于电解质的是
A.次氯酸 B.浓硫酸 C.氯气 D.二氧化硫
难度: 简单查看答案及解析
-
下列应用或事实与胶体的性质没有关系的是
A.用明矾净化饮用水
B.放电影时,放映室射到银幕上的光柱
C.氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀
D.滚滚长江流入大海处,形成长江三角沙洲
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列说法正确的是
A.7.1gCl2与足量的氢氧化钠溶液反应转移的电子数一定为0.2NA
B.在常温常压下,11.2 升氯气含有的分子数为0.5NA
C.常温常压下,32 g O2和O3的混合气体所含原子数为2NA
D.1 molFe与足量的Cl2反应转移的电子数为2NA
难度: 中等查看答案及解析
-
制取水处理剂ClO2的化学方程式为:2KClO3+H2C2O4+H2SO4═2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是
A.KClO3在反应中得到电子 B.ClO2是还原产物
C.H2C2O4在反应中被氧化 D.1molKClO3参加反应有2mol电子转移
难度: 中等查看答案及解析
-
相同质量的两份铝,分别放入足量的盐酸和氢氧化钠溶液中,放出的氢气在同温同压下的体积比为
A.1:1 B.1:6 C.2:3 D.3:2
难度: 中等查看答案及解析
-
下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象都相同的是
A.NaHSO4和Ba(OH)2 B.AlCl3和NaOH
C.NaAlO2和H2SO4 D.Na2CO3和H2SO4
难度: 简单查看答案及解析
-
进行化学实验操作必须正确、规范。下列说法中不正确的是
A.用滴管滴加液体时,滴管应垂悬在容器上方,不能触及容器内壁
B.用药匙或者纸槽把粉末状药品送入试管的底部
C.配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸
D.过滤时玻璃棒的末端应轻轻靠在三层的滤纸上
难度: 简单查看答案及解析
-
下列叙述中正确的是
①标准状况下,1 L HCl和1 L H2O的物质的量相同;
②标准状况下,1 g H2和14 g N2的体积相同;
③28 g CO的体积为22.4 L;
④两种物质的物质的量相同,则它们在标准状况下的体积也相同;
⑤同温同体积时,气体物质的物质的量越大,则压强越大;
⑥同温同压下,气体的密度与气体的相对分子质量成正比。
A.①②③ B.②⑤⑥ C.②③⑥ D.④⑤⑥
难度: 中等查看答案及解析
-
有五种化合物:①Mg(HCO3)2,②Al(OH)3,③Al,④(NH4)2CO3,⑤Al2O3.跟盐酸和NaOH溶液都能反应的物质有
A.二种 B.三种 C.四种 D.五种
难度: 中等查看答案及解析
-
下列说法不正确的是
①钠、氢气都能在氯气中燃烧生成白色烟雾
②铜丝在氯气中燃烧,生成蓝绿色的氯化铜
③液氯就是氯气的水溶液,它能使干燥的有色布条褪色
④久置的氯水,因氯气几乎完全挥发掉,剩下的就是水
A.只有① B.①和② C.①和④ D.①②③④
难度: 简单查看答案及解析
-
将等物质的量的SO2和Cl2混合后的气体溶解于适量的蒸馏水中,再滴入含有品红和BaCl2的混合溶液,则发生的实验现象是
①红色溶液很快褪色 ②红色溶液不褪色 ③有白色沉淀生成 ④溶液仍然透明
A. 仅①和④ B. 仅①和③ C. 仅②和③ D. 仅②和④
难度: 简单查看答案及解析
-
2.1g平均相对分子质量为7.2的CO与H2组成的混合气体与足量的O2充分燃烧后,立即通入足量的Na2O2固体中,固体的质量增加
A.2.1g B.3.6g C.7.2g D.不可求
难度: 简单查看答案及解析
-
在标况下,将HCl充满一个干燥烧瓶,将烧瓶倒置于水中,瓶内液面上升,最后烧瓶内溶液的物质的量浓度为:(假设溶质不扩散)
A.0.045mol/L B.0.036mol/L C.0.026mol/L D.0.030mol/L
难度: 简单查看答案及解析
-
15g铁粉和氧化铁的混合物,放入150mL稀H2SO4中,发现固体完全溶解,并放出1.68L H2(标准状况),加入KSCN溶液后,无颜色变化。为了使Fe2+完全转化为Fe(OH)2沉淀,共耗用200mL 3 mol/L NaOH溶液,则原硫酸溶液的物质的量浓度为
A.4 mol·L—1 B.3 mol·L—1 C.2 mol·L—1 D.1 mol·L—1
难度: 简单查看答案及解析
-
已知:2Fe3++2I-=2Fe2++I2,向1L含有Fe2+、I━、Br━的溶液中通入适量氯气,溶液中各种离子的物质的量变化如下图所示。横、纵坐标的单位均为mol。有关说法不正确的是
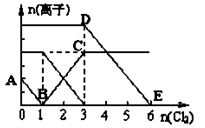
A.线段BC代表Fe3+物质的量的变化情况
B.原混合溶液中c(FeBr2)= 6 mol/L
C.原溶液中n (Fe2+): n (I-): n(Br-)=2:1:3
D.当通入Cl22mol时,溶液中已发生的反应可表示为2Fe2++2I━+2Cl2=2Fe3++I2+4Cl━
难度: 中等查看答案及解析