-
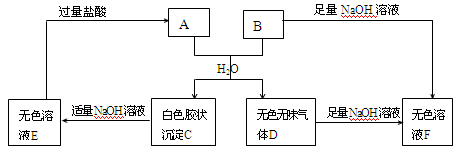
Mg(OH)2在下列四种情况下,其溶解度最大的是
A.在纯水中
B.在0.1 mol·L-1的NH3·H2O溶液中
C.在0.1 mol·L-1的CH3COOH溶液中
D.在0.1 mol·L-1的MgCl2溶液中
难度: 中等查看答案及解析
-
有一种新型燃料电池,工作时在一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。现用该燃料电池和惰性电极电解Na2SO4溶液一段时间,假设电解时温度不变,下列说法不正确的是
A.在熔融电解质中,O2-由正极移向负极
B.通入空气的一极是正极,电极反应式为O2+4e-===2O2-
C.电解池的阳极反应式为4OH--4e-===2H2O+O2↑
D.电解一共生成0.9 mol气体时,理论上消耗0.1 mol丁烷
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是
A.由水电离出来的c(H+)=10-12mol/L的溶液中:Na+、
、
、K+
B.使酚酞试液变红的溶液中:S2-、
、
、Na+
C.pH=0的溶液中:Na+、K+、Fe2+、
D.pH=7的溶液中:Al3+、Cl-、
、
难度: 中等查看答案及解析
-
升高温度,下列数据不一定增大的是
A.化学平衡常数K B.KNO3的溶解度S
C.化学反应速率
D.水的离子积常数KW
难度: 中等查看答案及解析
-
下图两个装置中,液体体积均为200 mL,开始工作前电解质溶液的浓度均为0.5 mol/L,工作一段时间后,测得有0.02 mol电子通过,若忽略溶液体积的变化,下列叙述正确的是
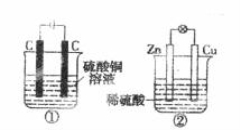
A.产生气体体积:①=②
B.电极反应式:①中阳极为4OH--4e-=2H2O+O2↑②中负极为2H++2e-=H2↑
C.溶液的pH变化:①减小,②增大
D.①中阴极质量增加,②中正极质量减小
难度: 中等查看答案及解析
-
关于下列各装置图的叙述中,不正确的是

A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
B.装置③中钢闸门应与外接电源的负极相连
C.装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+
D.装置④中的铁钉几乎没被腐蚀
难度: 中等查看答案及解析
-
下列有关物质的量浓度关系正确的是
A.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合,溶液呈酸性:c(CH3COO-)<c(CH3COOH)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.0.1 mol·L-1的NaHA溶液,其pH=4,则c(HA-)>c(H+)>c(H2A)>c(A2-)
D.pH=2的HA溶液与pH=12的MOH溶液任意比混合后溶液中离子浓度关系:c(H+)+c(M+)=c(OH-)+c(A-)
难度: 困难查看答案及解析
-
常温下,将C1 mol·L-1的盐酸和C2 mol·L-1的氨水等体积混合,下列叙述错误的是
A.c(NH4+)+c(H+)=c(Cl-)+c(OH-)
B.当C1= C2时,c(NH4+)+c(NH3·H2O)=c(Cl-)
C.当pH=7,一定是C2>C1
D.当pH<7,一定是C1=C2
难度: 中等查看答案及解析
-
下列叙述正确的是
A.常温下,反应C(s) + CO2(g)=2CO(g)不能自发进行,则该反应△H>0
B.强电解溶液的导电能力一定强于弱电解质溶液的导电能力
C.CH3COOH、Cu(OH)2、BaSO4、NH3都是常见的弱电解质
D.常温下就能发生的化学反应一定是放热反应
难度: 中等查看答案及解析
-
能说明0.1 mol·L-1的NaHA溶液一定呈酸性的是
A.某温度下,测得溶液的pH < 7
B.溶液中c(Na+)=c(A2-)
C.溶液中存在Na+、HA- 、 A2-、 H2A 多种微粒
D.NaHA溶液可与等体积等物质的量浓度的NaOH溶液恰好反应
难度: 简单查看答案及解析
-
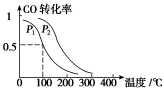
对于可逆反应:mA(g)+nB(g)
xC(g)+ yD(s) ΔH=?,在不同温度及压强(P1,P2)条件下,反应物A的转化率如下图所示,下列判断正确的是

A.ΔH>0,m+n>x+y B.ΔH<0,m+n>x+y
C.ΔH<0,m+n>x D.ΔH>0,m+n<x
难度: 中等查看答案及解析
-
某温度下,在一定体积的密闭容器中X、Y、Z、W四种气体的初始浓度和平衡浓度
如下表,下列说法错误的是
物质
X
Y
Z
W
初始浓度/mol·L-1
0.5
0.6
0
0
平衡浓度/mol·L-1
0.1
0.1
0.4
0.6
A.增大压强反应的平衡常数不变,但X的转化率增大
B.该反应的化学方程式为:4X (g)+5Y (g)
4Z (g)+ 6W (g)
C.反应达到平衡时,X的转化率为80%
D.其它条件不变,若增大Y的起始浓度,X的转化率增大
难度: 中等查看答案及解析
-
25℃时,浓度均为0.1 mol·L-1的HA溶液和BOH溶液,pH分别是1和11。下列说法正确的是
A.在0.1 mol·L-1BA溶液中,c(A-)+c(H+)=c(BOH)+c(B+)
B.若将0.1 mol·L-1 BOH溶液稀释至0.001 mol·L-1则溶液的pH=9
C.若将一定量的上述两溶液混合后pH=7,则混合液中:c(A-)>c(B+)
D.若将上述两溶液按体积比1∶1混合,则混合液中:c(A-)>c(B+)>c(H+)>c(OH-)
难度: 中等查看答案及解析
-
下列推论正确的是
A.H2(g)的燃烧热是285.8 kJ·mol-1,则2H2O(g)=2H2(g)+O2(g) ΔH=+285.8 kJ·mol-1
B.对于反应2H2O2==2H2O+O2↑,升高温度能加快O2的生成速率
C.已知2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1>ΔH2
D.在CuCl2水溶液中存在如下平衡:[Cu(H2O)4]2+(蓝)+4Cl—
[CuCl4]2—(绿)+4H2O,若向溶液中滴加足量AgNO3溶液,可使溶液呈现绿色
难度: 简单查看答案及解析
-
下列叙述中不正确的是
A.将NaAlO2溶液在蒸发皿中蒸干,最终得到的固体物质是Al(OH)3
B.溶液中c(H+)>c(OH—),该溶液一定显酸性
C.用原电池作电源进行电解时,电子从原电池负极流向电解池阴极
D.外加电流的阴极保护法,构成了电解池;牺牲阳极的阴极保护法构成了原电池
难度: 中等查看答案及解析
-
已知在25℃时,Ksp(AgCl)=1.8×10—10,Ksp(AgI)=8.3×10—17,下列说法错误的是
A.在100mL0.01mol/LKCl溶液中,加入1mL0.01mol/LAgNO3溶液,有沉淀析出
B.向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解度减小
C.由于Ksp(AgCl)>Ksp(AgI),AgCl 沉淀在一定条件下可转化为AgI沉淀
D.往氯化银的悬浊液中加硝酸银固体,c(Cl—)、c(Ag+)均减小
难度: 中等查看答案及解析
-
体积为1 L的某溶液中含有的离子如表所示:
离子
Cu2+
Al3+
Cl-
1
1
a
1
用Pt电极电解该溶液,当电路中有3 mol电子通过时(忽略电解时溶液体积的变化及电解产物可能存在的溶解现象),下列说法正确的是
A.阴极析出的金属是铜与铝 B.a=3
C.阳极生成1.5 mol Cl2 D.电解后溶液的pH=0
难度: 中等查看答案及解析
-
镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是:
A.充电时阳极反应:Ni(OH)2 -e- + OH- =NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH- 向正极移动
难度: 中等查看答案及解析