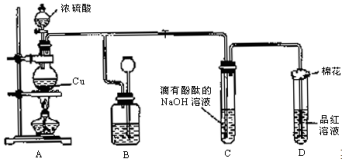
-
设NA为阿伏伽德罗常数的值,下列说法正确的是
①常温常压下,17g甲基(—14CH3)中所含的中子数为9NA
②常温常压下,6.4gCu与40mL 10mol·L-1浓HNO3作用,产生NO2分子的数目为0.2NA
③1.6g甲烷中含有的C—H键数目为0.1NA
④某温度时,1LpH=6的纯水中含有1.0×10-6NA个H+
⑤7.8g
中含有的碳碳双键数目为0.3NA
⑥20g氖气中所含的原子数目为NA
⑦25℃时,pH=12的NaHCO3溶液中含有OH-的数目为0.01NA
⑧含NA个阴离子的Na2O2溶于水形成1L溶液,其浓度为1 mol·L-1
A.①②⑦ B.④⑥ C.③⑤⑧ D.②③⑤⑥
难度: 困难查看答案及解析
-
下列说法正确的有几个
①任何元素在自然界中的存在形式都有化合态和游离态
②在化学变化中,分子可以再分,离子和原子不可以再分
③物质的化学性质一定是由分子保持的
④原子与该原子形成的简单离子相对质量几乎相等
⑤由同一种元素组成的物质一定是同一种物质
⑥质子数、中子数和电子数都相同的粒子一定是同一种粒子
⑦碱性氧化物一定是金属氧化物
⑧酸性氧化物不一定是非金属氧化物
A.3 B.4 C.5 D.6
难度: 中等查看答案及解析
-
下列说法正确的是
①SO2、NO2都能和碱溶液发生反应属于酸性氧化物,Fe2O3、Al2O3属于碱性氧化物
②碳酸钠、氢氧化钡、氯化铵、过氧化钠都属于离子化合物
③蔗糖、硝酸钾和硫酸钡分别属于非电解质、强电解质和弱电解质
④醋酸、烧碱、纯碱和生石灰分别属于酸、碱、盐和氧化物
⑤NaHCO3是发酵粉主要成分之一,Na2CO3可治疗胃酸过多
⑥盐酸属于混合物,而液氯、冰醋酸均属于纯净物
A.①③⑤ B.④⑤⑥ C.②③④ D.②④⑥
难度: 中等查看答案及解析
-
甲、乙、丙、丁四种易溶于水的物质,分别由NH4+、Ba2+、Mg2+、H+、OH-、Cl-、HCO3-、SO42-中的不同阳离子和阴离子各一种组成,将甲溶液分别与其他三种物质的溶液混合,均有白色沉淀生成,则甲为
A.MgSO4 B.Ba(HCO3)2 C.Mg(HCO3)2 D.Ba(OH)2
难度: 中等查看答案及解析
-
下列说法中不正确的是
A.常温下pH=7的溶液中:Fe3+、Mg2+、SO42-、Cl-能大量共存
B.在含有0.1mol·L-1 Fe3+的溶液中:SCN-、Cl-、K+不能大量共存
C.在含有HCO3-、SO32-、S2-、CH3COO-四种阴离子的溶液中加入足量的Na2O2固体后,CH3COO-浓度变化最小
D.常温下,水电离出c(H+)=10-10的溶液中:Na+、ClO-、S2-、NH4+不能大量共存
难度: 困难查看答案及解析
-
将17.9g由Al、Fe、Cu组成的合金溶于足量的NaOH溶液中,产生气体3.36L(标准状况);另取等质量的合金溶于过量的稀硝酸中,向反应后的溶液中加入过量的NaOH溶液,得到沉淀的质量为25.4g;若HNO3的还原产物仅为NO,则生成NO的标准状况下的体积为
A.2.24L B.4.48L C.6.72L D.8.96L
难度: 困难查看答案及解析
-
某废水含有下列离子中的5种(忽略水的电离及离子的水解),K+、Cu2+、Al3+、Fe2+、Cl-、CO32-、NO3-、SO42-,测得各种离子的物质的量浓度相等.为探究废水的组成,某同学进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃观察无紫色火焰
②另取溶液加入足量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变
③另取溶液加入BaCl2溶液,有白色沉淀生成
根据上述实验,以下推测正确的是
A.溶液中无法确定Al3+的存在与否
B.原溶液中不含的离子为:K+、Al3+、CO32-
C.步骤②中不可以确定Fe2+、NO3-的存在
D.步骤③中共有2种钡盐沉淀
难度: 困难查看答案及解析
-
下列离子方程式书写正确的是
A.向饱和碳酸氢钙溶液中加入过量的NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
B.KAl(SO4)2中滴加Ba(OH)2使SO42-恰好完全沉淀:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
C.氢氧化钠溶液吸收少量SO2气体:SO2+2OH-=SO32-+H2O
D.硫酸亚铁加过氧化氢溶液:Fe2++H2O2+2H+=Fe3++2H2O
难度: 困难查看答案及解析
-
常温下,在某200ml的稀硫酸和稀硝酸的混合溶液中逐量地加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(设硝酸只被还原为NO气体)。下列有关分析错误的是

A.原混合酸中NO3-的物质的量为0.2mol
B.原混合酸中H2SO4物质的量浓度为2mol·L-1
C.OA段与BC段反应中电子转移的物质的量之比为2:1
D.取20ml原混合酸加水稀释至1L后溶液的pH=1
难度: 困难查看答案及解析
-
取铜、镁合金完全溶于浓硝酸中,反应过程中硝酸被还原只产生0.896LNO2气体和0.672LN2O4的气体(气体体积都已折算到标准状况),在反应后的溶液中加足量的氢氧化钠溶液,生成沉淀质量为3.7g。则合金中铜与镁的物质的量之比等于
A.1:1 B.2:1 C.3:2 D.2:3
难度: 困难查看答案及解析
-
向一定量的含Fe、FeO、Fe2O3、Fe3O4的混合物中,加入150ml4mol·L-1的稀硝酸,恰好使混合物完全溶解,并放出标准状况下NO气体2.24L。往所得溶液中加KSCN溶液,无红色出现。若用一定量的氢气在加热条件下还原相同质量的该混合物,所得固体的物质的量可能为
A.0.30mol B.0.28mol C.0.25mol D.0.22mol
难度: 困难查看答案及解析
-
向20mL0.05mol·L-1NH4Al(SO4)2溶液中,滴加等物质的量浓度的Ba(OH)2溶液x mL,下列叙述正确的是
A.x=20时,溶液中有NH4+、AlO2-、SO42-,且c(NH4+)>c(SO42-)
B.x=20时,溶液中有NH4+、Al3+、SO42-,且c(NH4+)>c(Al3+)
C.x=60时,溶液中有Ba2+、Al3+、OH-,且c(OH-)=c(Ba2+)
D.x=60时,溶液中有Ba2+、AlO2-、OH-,且c(OH-)<c(AlO2-)
难度: 困难查看答案及解析
-
A~E是中学化学常见的5种化合物,A、B是氧化物,它们之间的转化关系如图所示。
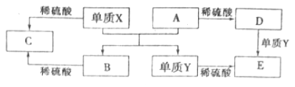
则下列说法正确的是
A.单质X与A反应的化学方程式:Al2O3+2Fe
Fe2O3+2Al
B.检验D溶液中金属阳离子的反应:Fe3++3SCN-=Fe(SCN)3↓
C.单质X和单质Y在一定条件下均能与水发生置换反应
D.由于化合物B和C均既能与酸反应,又能与碱反应,所以两者均是两性化合物
难度: 中等查看答案及解析
-
有一混合溶液,其中只含有Fe2+、Cl-、Br-、I-(忽略水的电离),其中Cl-、Br-、I-的个数比为2:3:4,向该溶液中通入氯气使溶液中Cl-和Br-的个数比为3:1,则通入氯气的物质的量与溶液中剩余Fe2+的物质的量之比为
A.7:1 B.7:2 C.7:3 D.7:4
难度: 中等查看答案及解析
-
由氢氧化钠(NaOH)和过氧化钠(Na2O2)组成混合物中检测出氢元素的质量分数为1%,那么混合物中钠元素的质量百分数约为
A.46% B.57.5% C.58.4% D.无法计算
难度: 困难查看答案及解析
-
已知:Fe(OH)3和Al(OH)3沉淀的生成与溶解的pH如下表。
氢氧化物
溶液pH
开始沉淀
沉淀完全
沉淀开始溶解
沉淀完全溶解
Fe(OH)3
2.3
3.4
——
——
Al(OH)3
3.3
5.2
7.8
12.8
向FeCl3、Al2(SO4)3的混合溶液中逐滴加入Ba(OH)2溶液,形成沉淀的情况如下图所示。以下推断错误的是
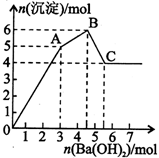
A.AB段可能发生的反应:2Ba2++3OH-+2SO42-+Al3+=2BaSO4↓+Al(OH)3↓
B.C点对应的沉淀:Fe(OH)3和BaSO4
C.OA段可能发生的反应:3Ba2++6OH-+3SO42-+Al3++Fe3+=3BaSO4↓+Fe(OH)3↓+Al(OH)3↓
D.据图计算原溶液中:c(Cl-)=c(SO42-)
难度: 困难查看答案及解析