-
pH=a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH>a,则该电解质可能是( )
A.Na2SO4
B.H2SO4
C.AgNO3
D.NaOH难度: 中等查看答案及解析
-
下列物质中,在一定条件下既能起加成反应,又能起取代反应,但不能使KMnO4酸性溶液褪色的是( )
A.苯
B.乙烷
C.乙烯
D.乙醇难度: 中等查看答案及解析
-
一定条件下,在密闭容器中,能表示反应X(g)+2Y(g)⇌2Z(g),一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比为1:2:2
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成n mol Z,同时生成2n mol Y.
A.①②
B.①④
C.②③
D.③④难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.物质发生化学反应的反应热仅指反应放出的热量
B.所有的燃烧都是放热反应
C.热化学方程式中各物质的化学计量数只表示物质的量,不表示分子的个数
D.热化学方程式中化学式前面的化学计量数可以是分数难度: 中等查看答案及解析
-
糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质.以下叙述正确的是( )
A.植物油不能使溴的四氯化碳溶液褪色
B.淀粉水解的最终产物是葡萄糖
C.葡萄糖能发生氧化反应和水解反应
D.蛋白质溶液遇硫酸铜后产生的沉淀能重新溶于水难度: 中等查看答案及解析
-
下列化学用语表达正确的是( )
A.羟基的电子式
B.乙烯的结构简式是CH2CH2
C.醛基的结构简式是-COH
D.淀粉的分子式是 (C6H10O5)n难度: 中等查看答案及解析
-
在一定条件下能发生水解反应的高分子化合物是( )
A.肥皂
B.油脂
C.纤维素
D.聚乙烯难度: 中等查看答案及解析
-
下列关于有机物的正确说法是( )
A.等物质的量的CH4与Cl2恰好反应时,生成CH3Cl与HCl
B.煤干馏可得到大量汽油和煤油
C.聚氯乙烯塑料最适合用来做蔬菜、水果及熟食等的保鲜膜
D.异丁烷()与正丁烷互为同分异构体
难度: 中等查看答案及解析
-
下列实验能获得成功的是( )
A.
用图所示装置,无水乙酸和乙醇共热制取乙酸乙酯
B.将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复原来的红色
C.用乙醇从碘水中萃取碘
D.淀粉用酸催化水解后的溶液加入新制银氨溶液,水浴加热,可看到有银镜出现难度: 中等查看答案及解析
-
下列说法正确的是( )
A.原电池是把电能转化为化学能的装置
B.形成原电池后,原电池中的阳离子移向正极
C.原电池中电子流出的一极是正极
D.原电池的两极发生的反应均为氧化还原反应难度: 中等查看答案及解析
-
已知充分燃烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是( )
A.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l);△H=-4b kJ/mol
B.C2H2(g)+O2(g)═2CO2(g)+H2O(l);△H=2b kJ/mol
C.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l);△H=2b kJ/mol
D.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l);△H=b kJ/mol难度: 中等查看答案及解析
-
同质量的锌与酸反应制备H2,欲使反应速率最大,下列条件中最佳组合是( )
①纯锌粒;
②粗锌片;
③0.01mol•L-1盐酸;
④0.01mol•L-1硫酸;
⑤98%硫酸;
⑥加热;
⑦用冰水冷却.
A.①③⑦
B.②④⑥
C.②③⑥
D.①⑤⑥难度: 中等查看答案及解析
-
使反应4NH3(g)+3O2(g)⇌2N2(g)+6H2O在2L的密闭容器中进行,半分钟后N2的物质的量增加了0.6mol.此反应的平均速率v(X)为( )
A.v(NH3)=0.02 mol•L-1•s-1
B.v(O2)=0.01 mol•L-1•s-1
C.v(N2)=0.02 mol•L-1•s-1
D.v(H2O)=0.02 mol•L-1•s-1难度: 中等查看答案及解析
-
可逆反应aA(g)+bB(g)⇌cC(g)+dD(g)△H,同时符合下列两图中各曲线的规律是( )
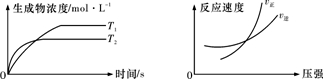
A.a+b>c+d T1>T2 △H>0
B.a+b>c+d T1<T2 △H<0
C.a+b<c+d T1>T2 △H>0
D.a+b<c+d T1<T2 △H<0难度: 中等查看答案及解析
-
某二元酸(化学式用H2A表示)在水中的电离方程式为:H2A═H++HA-⇌HA-H++A2-在0.1mol•L-1Na2A溶液中存在的粒子,其浓度关系正确的是( )
A.c(Na+)+c(H+)=c(OH-)+c(HA-)+c(A2-)
B.c(Na+)+c(OH-)=c(H+)+c(HA-)
C.c(Na+)=2 c(A2-)+2 c(HA-)+2 c(H2A)
D.c(A2-)+c(HA-)=0.1 mol•L-1难度: 中等查看答案及解析
-
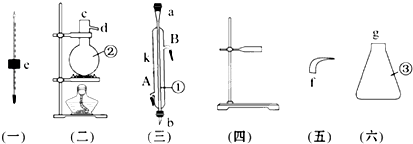
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A (g)+xB(g)⇌2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如图所示.下列说法中正确是( )

A.8min前A的平均反应速率为0.08mol/
B.30min时扩大容器的体积,40min时升高温度
C.反应方程式中的x=1,正反应为吸热反应
D.30min和54min的反应的平衡常数相等4难度: 中等查看答案及解析