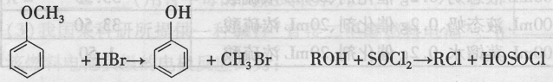-
2011年是国际化学年,化学与生活、社会密切相关。下列说法不正确的( )
A.农药和化肥对环境和人类健康有害,应该禁止使用
B.在食品中科学使用食品添加剂,有利于提高人类生活质量
C.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境
D.积极开发废电池的综合利用技术,能防止电池中的重金属等污染土壤和水体
难度: 中等查看答案及解析
-
下列有关化学用语正确的是 ( )

难度: 中等查看答案及解析
-
化学在生产和日常生活中有着重要的应用。下列说法不正确的是( )
A.铁盐比铝盐更适合做净水剂
B.光导纤维和石英玻璃主要成分都是二氧化硅
C.MgO和Al2O3都可以做耐火材料
D.合金一定比纯金属耐腐蚀
难度: 中等查看答案及解析
-
下列各组离子在指定溶液中能大量共存的是 ( )
①常温下,c(H+)/c(OH一)=1×10-12的溶液:K+、AlO2-、CO32-、Na+
②加入苯酚显紫色的溶液:K+、NH4+、Cl-、I一
③中性溶液:Fe3+、Al3+、NO3-、SO42-
④使pH试纸变蓝的溶液中:Al3+、Na+、SO42-、Cl一
⑤无色溶液中:K+、Al3+、NO3-、HCO3-
A.②③ B.①③ C.① D.①④⑤
难度: 中等查看答案及解析
-
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15;X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g·L-1,W在短周期主族元素中原子半径最大。下列说法正确的是( )
A.原子半径:Z>Y>X
B.M2Z能与W的单质发生反应
C.由X元素形成的单质一定是原子晶体
D.由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是 ( )
A.漂白粉溶液中通入过量二氧化碳:
Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO
B.NaOH溶液中滴人饱和FeCl3溶液:
Fe3++3H2O
3H++3Fe(OH)3(胶体)
C.将氯气溶于水配制氯水:Cl2+H2O
H++Cl-+HClO
D.用硫酸酸化的KMnO4溶液与H2O2反应:
2MnO4-+10H++3H2O2=2Mn2++3O2 ↑+8H2O
难度: 中等查看答案及解析
-
下列有关实验原理或实验操作正确的是 ( )
A.用pH试纸测定氯水的pH
B.过滤时为了加快过滤速度,可以用玻璃棒小心搅拌
C.选择合适的试剂,用右图所示装置可分别制取少量CO2和O2
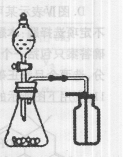
D.室温下向苯和苯酚的混合溶液中加入浓溴水,充分反应后过滤,可除去苯中少量苯酚
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数,下列叙述正确的是 ( )
A.1mol Cl2与足量的铁反应,转移的电子数为3NA
B.在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA
C.3.4gH2O2中含有的共用电子对数为0.1NA
D.标准状况下,lmol SO3含有的氧原子数为3NA
难度: 中等查看答案及解析
-
海洋中有丰富的食品、矿产、能源、药物和水产资源等(如下图所示)。

下列有关说法正确的是 ( )
A.在工段③和⑤中需要用到氯碱工业的产物
B.工段②中的MgCl2·6H2O可在空气中受热分解制无水MgCl2
C.大量的含Fe3+废水排人海洋,易引发赤潮
D.工段①中除去粗盐中的SO42-、Ca2+、Mg2+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液一过滤后加盐酸
难度: 中等查看答案及解析
-
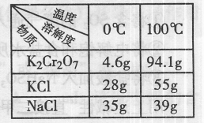
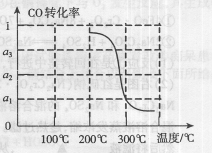
下列图示与对应的叙述相符的是 ( )
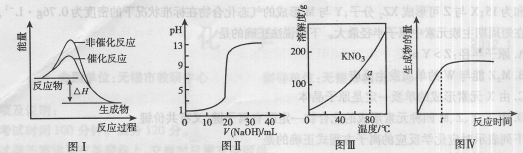
A.图I表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图Ⅱ表示0.1000mol·L-1 NaOH溶液滴定20.00mL 0.1000mol·L-1 CH3COOH溶液所得到的滴定曲线
C.图Ⅲ表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液
D.图Ⅳ表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时反应物转化率最大
难度: 中等查看答案及解析
-
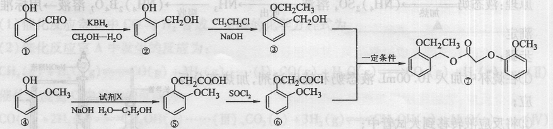
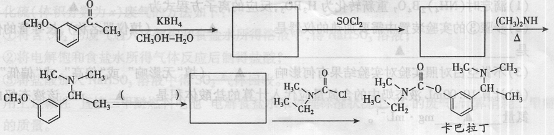
利用下图所示的有机物X可生产S-诱抗素Y(部分产物未写出)。下列说法不正确的( )

A.X、Y结构中都有手性碳原子
B.X分子中所有碳原子都在同一平面
C.Y可以发生取代、酯化、加成反应
D.1mo]Y最多消耗2mol NaOH
难度: 中等查看答案及解析
-
如右图所示,将两烧杯中电极用导线相连,四个电极分别为Mg、Al、Pt、C。当闭合开关S后,以下表述正确的是( )
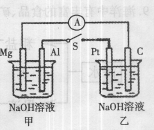
A.电流表指针不发生偏转
B.Al、Pt两极有H2产生
C.甲池pH减小,乙池pH增加
D.Mg、C两极生成的气体在一定条件下可以恰好完全反应
难度: 中等查看答案及解析
-
下列说法正确的是 ( )
A.常温下,反应4Fe(OH)2(s)+2H2O(1)+O2(g)=4Fe(OH)3(s)能自发进行,则该反应的△H<0
B.浑浊的苯酚试液中加入饱和Na2CO3溶液变澄清,则酸性:苯酚>碳酸
C.同一可逆反应使用不同的催化剂时,高效催化剂可增大平衡转化率
D.等体积、等物质的量浓度的HA与NaA(ttA为弱酸)混合,所得混合液的酸碱性取决于Ka(HA)的大小
难度: 中等查看答案及解析
-
25℃时,下列各溶液中有关物质的量浓度关系不正确的是
A.Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
B.0.1mol·L-1 pH为4的NaHB溶液中:c(HB一)>c(B2-)>c(H2B)
C.NH4HSO4溶液中滴加NaOH至溶液除好呈中性:
c(Na+)>c(SO42-)>c(NH4+)>c(OH一)=c(H+)
D.0.2mol·L-1的某一元弱酸HA溶液和0.1mol·L-1NaOH溶液等体积混合后的溶液:
2c(OH一)+c(A一)=2c(H+)+c(HA)
难度: 中等查看答案及解析
-
在温度相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒压,发生反应CH3OCH3(g)+H2O(g)
2CH3OH(g);△H=37kJ·mol-1,测得反应达到平衡时的有关数据如下:
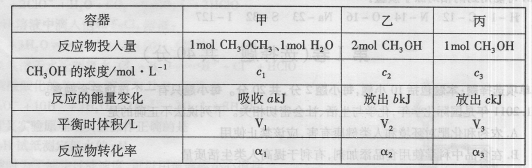
下列说法正确的是 ( )
A.
B.
C.V1=2V3 D.
难度: 中等查看答案及解析