-
下列说法或表示方法中正确的是( )
A.等质量的硫蒸气和硫固体分别完全燃烧,反应的热效应△H1>△H2
B.由C(石墨)→C(金刚石);△H=+1.9KJ/mol,可知1mol石墨的总键能比1mol金刚石的总键能大1.9kJ,即金刚石比石墨稳定
C.在101KPa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l);△H=+285.8KJ/mol
D.在稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-57.3KJ/mol,若将0.5mol浓H2SO4溶液与含1molNaOH的溶液混合,放出的热量大于57.3KJ难度: 中等查看答案及解析
-
生活中碰到的某些问题,常涉及到化学知识,下列分析不正确的是( )
A.Mg(OH)2和Al(OH)3热分解生成的气态水可覆盖火焰、驱逐O2、稀释可燃气体,分解产物MgO和Al2O3能较快地与塑料燃烧过程中产生的酸性及腐蚀性气体反应,所以它们可以作为未来发展方向的无机阻燃剂
B.光化学污染主要是由氮氧化物和碳氢化物引起的
C.铝制容器不能长期盛装酸性或碱性食品,但可用于长期腌制食品
D.蒙古牧民喜欢用银器盛放鲜牛奶有其科学道理:用银器盛放鲜牛奶,溶入的极微量的银离子,可杀死牛奶中的细菌,防止牛奶变质难度: 中等查看答案及解析
-
某合作学习小组讨论辨析下列说法正确的是( )
A.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
B.蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
C.Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到
D.天然气、石油和煤均属于可再生能源难度: 中等查看答案及解析
-
金属铜的提炼多从黄铜矿开始.黄铜矿的焙烧过程中主要反应之一的化学方程式为:2CuFeS2+O2=
+2FeS+SO2
下列说法不正确的是( )
A.方框中的物质应为Cu2S
B.O2只作氧化剂
C.SO2既是氧化产物又是还原产物
D.若有1molSO2生成,则反应中有4mol电子转移难度: 中等查看答案及解析
-
常温下,下列溶液中可能大量共存的离子组是( )
A.含有大量S2-的溶液:Na+、ClO-、Cl-、CO32-
B.含有大量Al3+的溶液:K+、Na+、AlO2-、SO42-
C.能使pH试纸变红的溶液:NH4+、Na+、NO3-、HCO3-
D.水电离产生的c(H+)=1×10-12mol•L-1的溶液:Mg2+、SO42-、NO3-、Cl-难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数.下列叙述正确的是( )
A.常温下,1molNaHCO3投入足量稀盐酸中,待反应结束后,可逸出NA个CO2分子
B.在含有NA个醋酸根离子(CH3COO-)的醋酸溶液中,氢离子(H+)数目略大于NA
C.1molCH3+(碳正离子)中含电子数目为10NA
D.1mol•L-1Mg(NO3)2溶液中含有NO3-的数目为2NA难度: 中等查看答案及解析
-
将铝粉与某铁的氧化物FeO•2Fe2O3粉末配制成铝热剂,分成两等份.一份直接放入足量的烧碱溶液中,充分反应后放出气体在标准状况下的体积为15.68L;另一份在高温下恰好反应完全,反应后的混合物与足量的盐酸反应后,放出的气体在标准状况下的体积为( )
A.11.20L
B.15.68L
C.22.40L
D.31.36L难度: 中等查看答案及解析
-
现有下列短周期元素的数据
下列说法中,正确的是( )元素性质\元素编号 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧ 原子半径 0.74 1.60 1.52 1.10 0.99 1.86 0.75 0.82 最高化合价 +2 +1 +5 +7 +1 +5 +3 最低化合价 -2 -3 -1 -3
A.元素原子序数④小于⑦
B.②、③号元素处于同一周期
C.⑤号元素最高价氧化物的水化物酸性最强
D.⑧号元素是金属元素难度: 中等查看答案及解析
-
下列反应的离子方程式不正确的是( )
A.FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+=4Fe3++2H2O
B.物质的量相等的溴化亚铁跟氯气反应2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
C.向明矾溶液中滴加Ba(OH)2,恰好使SO42-沉淀完全:2A13++3SO42-+3Ba2++6OH-═2A1(OH)3↓+3BaSO4↓
D.向碳酸钠溶液中滴加过量的稀硫酸:CO32-+2H+=CO2↑+H2O难度: 中等查看答案及解析
-
工业上制取CuSO4不是直接用铜与浓H2SO4反应,而是将Cu和少量的Ag的混合物浸在稀硫酸中并不断从容器下部吹入细小的空气泡,这样的优点是①不产生污染大气的SO2 ②提高H2SO4的利用率 ③节约能源; ④提高铜的利用率( )
A.①②③
B.①④
C.①②③④
D.只有①②难度: 中等查看答案及解析
-
下列叙述中正确的是( )
A.两种微粒,若核外电子排布完全相同,则其化学性质一定相同
B.凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布
C.两原子,如果核外电子排布相同,则一定属于同种元素
D.阴离子的核外电子排布一定与上一周期稀有气体元素原子的核外电子排布相同难度: 中等查看答案及解析
-
如图,B为常见金属或非金属单质,有下列转化关系:若C是可用作自来水消毒的气体,D、E是氧化物,D转化为E时,增加氧的质量约是D物质总质量的25.8%,则A是( )
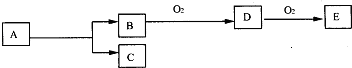
A.AlCl3
B.H2O2
C.KCl
D.NaCl难度: 中等查看答案及解析
-
下列各组溶液中所含溶质的物质的量相等,将其充分混合后不会产生沉淀的是( )
A.CaCl2、NaHCO3、KOH
B.MgCl2、Ba(OH)2、HCl
C.FeCl3、H2S、HCl
D.NaAlO2、K2CO3、NH3•H2O难度: 中等查看答案及解析
-
混合下列各组物质使之充分反应并加热蒸干,产物灼烧至质量不变,最终残留固体不是纯净物的是( )
A.在KI溶液中通入过量氯气
B.等物质的量浓度、等体积的(NH4)2SO4溶液与BaCl2溶液混合
C.物质的量之比为2:1的NaHCO3与Na2O2固体溶于水中
D.向Na2SiO3溶液中通入足量的CO2难度: 中等查看答案及解析
-
陈老师在课堂上做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色.若将烧杯中的溶液换成含有少量KSCN 的FeCl2溶液,溶液呈血红色.判断下列说法中正确的是( )
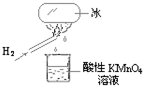
A.该条件下生成的水分子化学性质比较活泼
B.该条件下H2被冷却为液态氢,液氢的水溶液具有还原性
C.该条件下H2燃烧生成了既具有氧化性又具有还原性的物质
D.该条件下H2燃烧的产物中可能含有一定量的H2O2难度: 中等查看答案及解析
-
将4.6 g Na和2.7 g Al同时加入到足量的水中充分反应,将反应后的溶液稀释、定容为500mL.下列说法正确的是( )
A.反应中放出的气体在标准状况下的体积为2.24L
B.参加反应的水的质量与加入Al的质量相等
C.所得溶液中Na+和Al3+的物质的量之比为2:1
D.所得溶液中阳离子和阴离子的物质的量之比为1:1难度: 中等查看答案及解析