-
下列质量增加的变化有一种与其他三种存在着本质的区别,这种变化是( )
A.长期放置在空气中的氢氧化钠质量增加
B.久置在潮湿空气中的铁钉质量增加
C.久置在空气中的生石灰质量增加
D.长期敞口放置的浓硫酸质量增加难度: 中等查看答案及解析
-
过氧乙酸常用来配制消毒液,过氧乙酸的化学式为C2H4O3.下列叙述中正确的是( )
A.过氧乙酸是由9个原子构成的
B.过氧乙酸的相对分子质量为76g
C.过氧乙酸中碳、氢、氧元素的质量比为6:1:12
D.一个过氧乙酸分子中,碳、氢、氧原子的个数比为1:2:3难度: 中等查看答案及解析
-
工业上用氨气(NH3)制取硝酸(HNO3),工业流程为:
①4NH3+5O24NO+6H2O
②2NO+O22NO2
③3NO2+H2O=2HNO3+NO,
下列判断不正确 的是( )
A.②为化合反应
B.一氧化氮(NO)的化学性质稳定
C.上述含氮物质中氮元素的化合价有-3,+2,+4,+5
D.制取硝酸过程中产生的NO可循环使用难度: 中等查看答案及解析
-
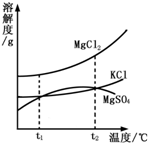
甲、乙两物质的溶解度曲线如图所示,下列叙述中正确的是( )
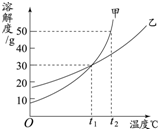
A.t1℃时,甲和乙的饱和溶液中溶质的质量分数相等
B.t1℃时,甲、乙各30g分别加入70g水中均能恰好完全溶解
C.t2℃时,在l00g水中放入60g甲,所得溶液溶质的质量分数为37.5%
D.将t1℃时甲和乙的饱和溶液同时升温至t2℃,甲溶液的溶质质量分数将比乙的大难度: 中等查看答案及解析
-
右图是某燃煤发电厂处理废气的装置示意图.下列说法正确的是( )
①此过程中没有发生分解反应
②此过程中S元素的化合价未发生改变
③使用此废气处理装置可减少酸雨的形成
④整个过程的反应可表示为:SO2+CaCO3═CaSO4+CO2.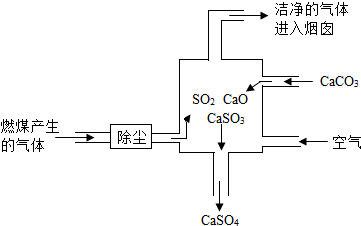
A.③
B.①③
C.②③④
D.③④难度: 中等查看答案及解析
-
向一定溶质质量分数的蔗糖溶液中加入10g蔗糖,完全溶解后,得到溶质质量分数为30%的蔗糖溶液100g.则原蔗糖溶液溶质质量分数约为( )
A.10%
B.11%
C.20%
D.22%难度: 中等查看答案及解析