-
下列说法错误的是
A. 任何化学反应都伴随着能量变化
B. 化学反应中能量变化的大小与反应物的质量多少无关
C. 化学变化中的能量变化主要是由化学键变化引起的
D. 能量变化是化学反应的基本特征之一
难度: 简单查看答案及解析
-
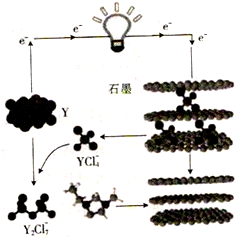
随着科技的发展,研究物质的方法越来越多,N3-、N5+、H3、O4、C60等已被发现。下列有关说法中正确的是
A. N5+和N3-相差16个电子 B. O3与O4属于不同的核素
C. C60属于共价化合物 D. H2与H3属于同素异形体
难度: 中等查看答案及解析
-
钛(Ti)金属常被称为未来钢铁。钛元素的同位素
Ti、
Ti、
Ti、
Ti、
Ti的原子核内, 中子数不可能为
A. 30 B. 28 C. 26 D. 24
难度: 简单查看答案及解析
-
电池与现代人的生活密切相关,某同学为了研究原电池原理设计了如图所示的装置。下列说法错误的是

A. X、Y不用导线连接时,铜棒上会有银析出
B. X和Y用导线连接时,银棒上发生的电极反应为Ag++e-==Ag
C. X和Y用导线连接时,电子由银经导线移向铜,再经电解质溶液移向银
D. 无论X和Y是否用导线连接,铜棒均会溶解,溶液都从无色逐渐变成蓝色
难度: 中等查看答案及解析
-
下列反应中既属于氧化还原反应,又属于吸热反应的是
A. 灼热的炭与CO2反应 B. Ba(OH)2·8H2O与NH4Cl反应
C. 铝片与稀H2SO4反应 D. 甲烷在O2中的燃烧反应
难度: 简单查看答案及解析
-
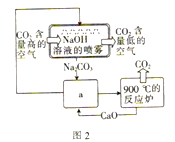
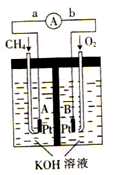
关于下列图示的说法中正确的是
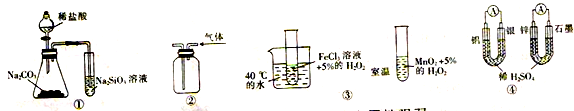
A. 用图①所示实验可比较氯、碳、硅三种元素的非金属性强弱
B. 用图②所示实验装置通过排空气法收集CO气体
C. 图③所示装置可用于探究温度对H2O2分解反应速率的影响
D. 图④两个装置中通过导线的电子数相相同时,生成的H2的物质的量也相同
难度: 中等查看答案及解析
-
炼铁高炉中冶炼铁的反应为Fe2O3(s)+3CO(g)
2Fe(s) + 3CO2(g),下列说法正确的是
A. 升高温度,反应速率减慢
B. 某温度下达到平衡时,
不再随时间而变化
C. 增加炼铁高炉的高度可减少尾气中CO的浓度
D. 当反应达到化学平衡时,v(正)=v(逆)=0
难度: 中等查看答案及解析
-
可逆反应:2A(g) + 3B(g)
2C(g)+D(g),在四种不同条件下的反应速率分别为:
①υ(A)=0.5mol·L-1·min-1 ②υ(B)=0.6 mol·L-1·min-1
③υ©=0.35 mol·L-1·min-1 ④υ(D)=0.4 mol·L-1·min-1
该反应在这四种不同条件下反应速率由快到慢的顺序是
A. ①②③④ B. ②①④③ C. ④①②③ D. ②④①③
难度: 中等查看答案及解析
-
对于放热反应:H2+Cl2
2HCl,下列说法中正确的是
A. 反应物所具有的总能量高于产物所具有的总能量
B. 产物所具有的总能量高于反应物所具有的总能量
C. 断开1 mol H—H键和1 mol C1—C1键所吸收的总能量大于形成2 mol H—C1键所放出能量
D. 该反应中,化学能只转变为热能
难度: 简单查看答案及解析
-
将等质量的镁球和铜球用导线连接在一铁棒上,平行插入CuSO4溶液中(如图),一段时间后,关于两球高度的说法正确的是

A. 左端高 B. 右端高 C. 一样高 D. 无法确定
难度: 中等查看答案及解析
-
总结是一种重要的学习方法,某兴趣小组得出结论:①硫酸比次氯酸稳定②硫酸的酸性弱于高氯酸③H2S比HC1易被氧化④气态HC1比气态H2S稳定⑤盐酸的酸性比H2S的酸性强。上述事实能够说明硫的非金属性比氯的非金属性弱的是
A. ①②③ B. ③④⑤ C. ②③④ D. ①③⑤
难度: 中等查看答案及解析
-
由下列各组材料和电解质溶液能组成原电池的是
选项
A
B
C
D
两极材料
Mg、Mg
Zn、Fe
金刚石、Cu
Zn、Cu
电解质溶液
稀H2SO4
乙醇
浓 H2SO4
稀盐酸
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列状态中,可以证明可逆反应N2 + 3H2
2NH3已达平衡状态是
①一个N≡N键断裂的同时,有3个H—H键断裂
②一个N≡N键断裂的同时,有6个N—H键断裂
③其他条件不变时,体系压强不再改变
④ω(NH3)、ω(N2)和ω(H2)都不再改变
⑤恒温恒容时,密度保持不变
⑥υ正(H2)=0.03 mol·L-1·min-1,υ逆(NH3)=0.02 mol·L-1·min-1
A. 全部 B. ②③④⑥ C. ③④⑤⑥ D. ②③④⑤⑥
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W的原子序数依次增大,且原子最外层电子数之和为13。X的原子半径比Y的小,X与W同主族,Z是地壳中含M最高的元素。下列说法错误的是
A. 原子半径的大小顺序:r(W)>r(Y)>r(Z)
B. 元素Z、W的简单离子的电子层结构相同
C. 元素Z分別与X、Y、W形成的化合物均为共价化合物
D. 只含X、Y、Z三种元素的化合物可能是离子化合物
难度: 中等查看答案及解析