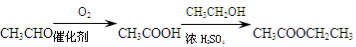-
下列说法不正确的是
A.离子交换膜在工业生产中广泛应用,如氯碱工业使用了阴离子交换膜
B.甲醛与尿素反应得到的脲醛树脂是一种高分子黏合剂,广泛应用于木材加工业,是居室甲醛污染的主要来源
C.目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造更好的晶体管
D.温室效应导致海水的酸度增加,珊瑚、贝壳类等生物的生存将会受到威胁
难度: 简单查看答案及解析
-
下列说法正确的是
A.往海带灰的浸泡液中加入过量的氯水,保证I-完全氧化为I2
B.在食醋总酸含量的测定中,没有控制好滴定终点,溶液显深红色,则必须重做实验
C.阿司匹林具有抑制血小板凝聚作用,可用于治疗心血管疾病,因其具有较强的酸性,常制成阿司匹林肠溶片
D.摩尔盐的制备实验中,将FeSO4和(NH4)2SO4混合液在蒸发皿中蒸发至有大量晶体析出,抽滤,并用少量酒精洗去晶体表面的水分
难度: 简单查看答案及解析
-
A、B、C、D、E均为短周期主族元素,B、C、D在周期表中的位置关系如下图所示。A是短周期中原子半径最小的元素,A、B、C三种元素的原子序数之和等于D元素的原子序数,E是短周期中最活泼的金属元素。下列说法错误的是
B
C
D
A.简单离子的半径大小关系:B>C>E
B.C元素的气态氢化物比D元素的气态氢化物稳定是氢键的缘故
C.由A、B两种元素组成的离子化合物NH5中,阴、阳离子个数比为1:1
D.由C、D、E三种元素组成的某种化合物,其水溶液能与盐酸反应产生沉淀
难度: 简单查看答案及解析
-
下列说法正确的是
A.某烷烃的名称为2,2,4,4-四甲基-3,3,5-三乙基己烷
B.等质量的甲醛与乳酸[CH3CH(OH)COOH]完全燃烧消耗氧气的量不相等
C.结构片段为
的高聚物,是其单体通过缩聚反应生成
D.化合物
在酸性条件下水解,所得溶液加碱后加热有NH3生成
难度: 简单查看答案及解析
-
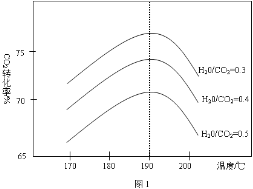
25℃时,相同体积和pH的NaX、NaY、NaZ三种盐溶液,分别加水稀释,溶液pH的变化与所加水的体积关系如图所示。下列说法正确是
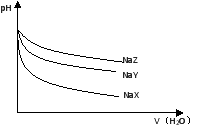
A.在上述三种盐原溶液中,水的电离度大小是NaX>NaY>NaZ
B.在等物质的量浓度的NaX、NaY、NaZ混合液中,离子浓度的大 小关系是c(Z-)>c(Y-)>c(X-)
C.在上述NaX和NaY的混合液中存在c(HX)/c(X-)=c(HY)/c(Y-)
D.在0.2mol·L-1 NaX溶液中加入等体积0.1mol·L-1的盐酸,所得混合液中存在c(H+)+c(HX)=c(OH-)+c(Cl-)
难度: 简单查看答案及解析
-
某固体粉末甲中可能含有K2CO3、KNO3、NaNO2、K2SO3、Na2SO4、FeO、Fe2O3中的若干种,某同学为确定该固体粉末的成分,取甲进行连续实验,实验过程及现象如下:
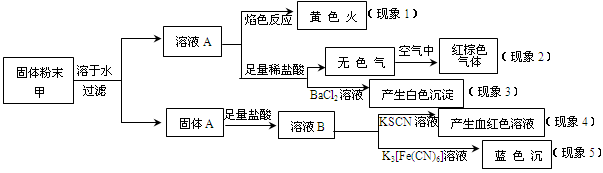
该同学得出的结论正确的是
A.根据现象1可推出该固体粉末中含有钠元素,但不含钾元素
B.根据现象2可推出该固体粉末中一定含有NaNO2
C.根据现象3可推出该固体粉末中一定含有Na2SO4
D.根据现象4和现象5可推出该固体粉末中一定含有FeO和Fe2O3
难度: 中等查看答案及解析
-
新型无机非金属材料甲和乙均是高温陶瓷材料,硬度大、熔点高、化学性质稳定。甲、乙分别由原子序数依次增大的X、Y、Z三种短周期元素中的两种组成。甲与NaOH浓溶液共热生成气体丙和化合物丁,丙在标准状况下的密度为0.76g·L-1,在丁溶液中滴加盐酸至过量,先生成白色沉淀后溶解。Z元素的氧化物是制造光导纤维的主要材料,在1300℃~1400℃的条件下,0.1mol的X单质与4.2g的Z单质恰好反应制得乙。请回答下列问题:
(1)乙的化学式为__________;丙的电子式为__________。
(2)甲与NaOH浓溶液共热的化学方程式为__________________________________________。
(3)丁溶液中通入少量CO2的离子方程式为________________________________________。
(4)高温条件下,丙与Fe2O3反应生成Fe和X单质,写出该反应的化学方程式为____________________,有人提出生成的产物Fe中可能还有FeO,请设计实验方案验证之(用化学方法)____________________。
(5)工业上在X单质的气氛下将Z的氧化物和焦炭加热到1400℃~1450℃的条件下以制备乙,反应中还生成一种常见的可燃性气体戊,该反应的化学方程式为____________________。
难度: 中等查看答案及解析