-
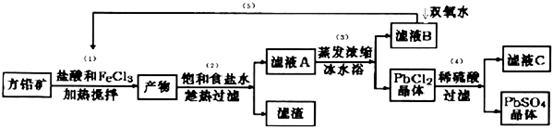
下列叙述正确的是
A. 泡沫灭火器中用的是苏打和硫酸铝
B. 沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强
C. 理想的催化剂可以大幅度提高目标产物在最终产物的比率
D. Na与H2O的反应是熵减的放热反应,该反应能自发进行
难度: 中等查看答案及解析
-
下列说法正确的是
A. 通过干馏可将煤中含有的苯、甲苯等物质分离出来
B. 有机玻璃、聚酯纤维(涤纶)均由加聚反应生成
C. 地沟油制得的生物柴油和裂化汽油都是烃
D. 乙烯与氧气生成环氧乙烷原子利用率为100%
难度: 中等查看答案及解析
-
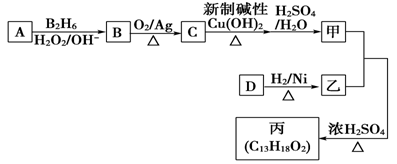
分子式为C8H8O2的含苯环有机物,能与NaHCO3溶液反应生成气体,则符合上述条件的同分异构体(不考虑立体异构)有( )
A. 2种 B. 3种 C. 4种 D. 5种
难度: 中等查看答案及解析
-
某电动汽车配载一种可充放电的锂离子电池。放电时电池的总反应为:Li1-xCoO2+LixC6=LiCoO2+ C6(x<1)。下列关于该电池的说法不正确的是
A. 放电时,Li+在电解质中由负极向正极迁移
B. 放电时,负极的电极反应式为LixC6 - xe-= xLi++ C6
C. 充电时,若转移1mole-,石墨C6电极将增重7xg
D. 放电时,正极上锂元素的化合价没有改变
难度: 困难查看答案及解析
-
短周期主族元素X、Y、Z、W原子序数依次增大,X原子的最外层有6个电子,Y是迄今发现的非金属性最强的元素,在周期表中Z位于IA族,W与X属于同一主族。下列说法正确的是
A.元素X、W的简单阴离子具有相同的电子层结构
B.由Y、Z两种元素组成的化合物是离子化合物
C.W的简单气态氢化物的热稳定性比Y的强
D.原子半径:r(X)<r(Y)<r(Z)<r(W)
难度: 中等查看答案及解析
-
对下列装置作用的分析或解释正确的是

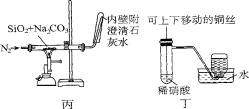
A.装置甲可除去HCl中的Cl2杂质
B.装置乙可吸收SO2,并防止倒吸
C.装置丙石灰水变浑浊即可证明非金属性:Si>C
D.装置丁可制取并收集NO气体
难度: 中等查看答案及解析
-
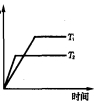
下列图示与对应的叙述相符的是
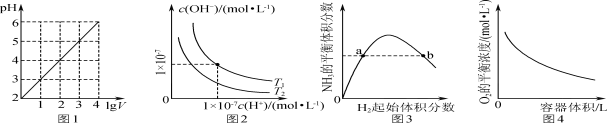
A.图1表示1 L pH=2的CH3COOH溶液加水稀释至V L,pH随lg V的变化
B.图2表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T2>T1
C.图3表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率小于b点
D.图4表示同一温度下,在不同容积的容器中进行反应2BaO2(s)
2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
难度: 简单查看答案及解析