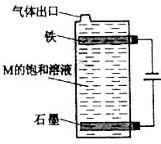
-
下列关于氯的说法正确的是
A.Cl2在化学反应中既能作氧化剂,又能作还原剂
B.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
C.Cl2通入到含有酚酞的NaOH溶液中,红色褪去,因为氯气有漂白性
D.将SO2通入次氯酸钙溶液可生成次氯酸
难度: 中等查看答案及解析
-
下列叙述中指定粒子数目一定大于NA的是
A.11.2L氧气和臭氧的混合气体所含的原子数
B.1mol CaC2固体中含阴离子总数
C.1L1mol/LCH3COOH溶液中所含分子总数
D.1molCl2参加化学反应获得的电子数
难度: 中等查看答案及解析
-
下列对应的表达方式错误的是
A .Cl-的结构示意图
B.氢氧根离子的电子式:
C.碳-12原子
D.HClO的结构式 H-Cl-O
难度: 中等查看答案及解析
-
下列关于SO2性质的分析,正确的是
A.通入BaCl2溶液中,有白色沉淀生成 B.通入FeCl3溶液中,有SO42-生成
C.通入氯水中,有淡黄色沉淀生成 D.通入KI溶液中,有I2生成
难度: 中等查看答案及解析
-
生活中下列处理方法正确的是
A.氯气易液化,液氯可以保存在钢瓶中 B.食盐可作调味剂,不能作食品防腐剂
C.纺织品上的油腻用烧碱溶液清洗 D.把铁器具浸入水隔绝空气防生锈
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.Na2S2O3溶液中加入稀硫酸:2S2O32— + 4H+ = SO42— + 3S↓ + 2H2O
B.用铜作电极电解CuSO4溶液:2Cu2+ + 2H2O
2Cu + O2↑+ 4H+
C.将H2O2滴加到酸性KMnO4溶液中:2MnO4—+H2O2+6H+=2Mn2+ +3O2 ↑ +4H2O
D.向含有FeBr2溶液中通入少量的Cl2:2Fe2++Cl2=2Fe3++2Cl—
难度: 中等查看答案及解析
-
下列说法正确的是
A.自然界中含有大量的游离态的硅,纯净的硅晶体可用于制作计算机芯片
B.硅酸钠的水溶液俗称水玻璃,可用作木材防腐剂
C.水泥、玻璃、水晶都是硅酸盐制品
D.二氧化硅不与任何酸反应,可用石英制造耐酸容器
难度: 中等查看答案及解析
-
X、Y两种元素形成含氧酸A和B,能说明酸A比酸B强的是
A.酸A中X的非金属性比酸B中Y的非金属性强
B.酸A中X与酸B中Y在同一周期,且X在Y之后
C.酸A与酸B的铵盐溶液反应生成酸B
D.酸A具有强氧化性,酸B没有强氧化性
难度: 中等查看答案及解析
-
能大量共存的一组离子是
A.K+、Ca2+、Cl-、NO3- B.H+、Na+、Fe2+、MnO4-
C. Na+、H+、SO42-、ClO- D.K+、AlO2-、Cl-、HCO3-
难度: 中等查看答案及解析
-
下列不能达到实验目的的是
序号 实验内容 实验目的
A 用石墨电极电解Mg(NO3)2、Cu( NO3)2 的混合液 比较确定铜和镁的金属活动性强弱
B 测同温同浓度Na2CO3和Na2SiO3水溶液的pH 确定碳和硅两元素非金属性强弱
C 室温下,用pH试纸测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH 比较HClO和CH3COOH的酸性强弱
D 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 研究浓度对反应速率的影响
难度: 中等查看答案及解析
-
下列说法不正确的是
A.利用分液漏斗进行分液操作时,先打开分液漏斗旋塞,使下层液体慢慢流出,待下层液体完全流出后,关闭旋塞,上层液体再从上面倒出
B.固体药品取用:块状固体用镊子夹取,粉末状的用药匙或纸槽转移
C.在用简易量热计测定反应热时,可使用碎泡沫起隔热保温的作用、环形玻璃搅拌棒进行搅拌、酸和过量的碱充分反应、取2—3 次的实验平均值,以达到良好的实验效果
D.用标准浓度的盐酸滴定未知浓度NaOH溶液时,酸式滴定管未用同浓度盐酸润洗,将导致测定结果偏低
难度: 中等查看答案及解析
-
下列各组物质的无色溶液,不用其它试剂即可鉴别的是
①KOH Na2SO4 AlCl3 ②NaHCO3 NaNO3 H2SO4
③HCl NaAlO2 NaCl ④Ca(OH)2 Na2CO3 BaCl2
A.①③ B.②③ C.①④ D.①②
难度: 中等查看答案及解析
-
将下图所示实验装置的K闭合,下列判断错误的是
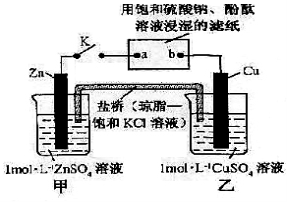
A.盐桥中的K+移向乙池
B.电子沿Zn
a
b
Cu路径流动
C.b电极上的反应式为4OH-—4e-=O2↑+2H2O
D.片刻后可观察到滤纸a点变红色
难度: 中等查看答案及解析
-
研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到直观形象
的效果。下列表达不正确的是
A.密闭容器中CuO和C高温反应的气体产物:
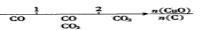
B.Fe在Cl2中的燃烧产物:

C.向AlCl3溶液中滴加NaOH后铝的存在形式:
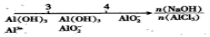
D.氨水与SO2反应后溶液中的铵盐:
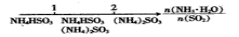
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数,下列说法中正确的有
①20 g D2O含有的电子数为10NA ②常温下,4 g CH4含有NA个C-H共价键
③10 mL质量分数为98%的H2SO4,加水至100 mL,H2SO4的质量分数为9.8%
④标准状况下,5.6L四氯化碳含有的分子数为0.25NA
⑤25 ℃时,pH=12的1.0 L CH3COONa溶液中水电离出的OH-的数目为0.01NA
⑥1 mol Na2O2与水完全反应时转移电子数为2NA
A.5个 B.2个 C.3个 D.4个
难度: 中等查看答案及解析
-
下列装置或操作能达到实验目的的是

难度: 中等查看答案及解析
-
下列物质分类正确的是
A.SO2、SiO2、CO均为酸性氧化物
B.稀豆浆、硅酸、氯化铁溶液均为胶体
C.烧碱、冰醋酸、四氯化碳均为电解质
D.福尔马林、水玻璃、氨水均为混合物
难度: 中等查看答案及解析
-
在温度相同、容积均为2L的3个恒容密闭容器中,按不同方式投入反应物,保持恒温,测得反应达到平衡时的有关数据如下,下列说法正确的是
(已知N2(g)+3H2(g)=2NH3(g) △H=−92. 4kJ·mol-1)
容器
甲
乙
丙
反应物投入量
1mol N2、3mol H2
2mol N2、6mol H2
2mol NH3
NH3的浓度( mol·L-1)
c1
c2
c3
反应的能量变化
放出Q1kJ
放出Q2kJ
吸收Q3kJ
体系压强(Pa)
p1
p2
p3
反应物转化率
α1
α2
α3
A.2p1=2p3<p2 B. 达到平衡时丙容器中NH3的体积分数最大
C.α2+α3<1 D.Q3+92.4 c1=92.4
难度: 中等查看答案及解析
-
下列说法正确的是
A.铅蓄电池在放电过程中,负极质量减小,正极质量增加
B.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0
C.一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率
D.相同条件下,溶液中Cu2+、Fe3+、Zn2+的氧化性依次增强
难度: 中等查看答案及解析
-
下列说法正确的是:
A.在100 ℃、101 kPa条件下,1mol液态水气化时需要吸收40.69 kJ的热量,则H2O(g)
H2O(l) 的ΔH = +40.69 kJ·mol-1
B.已知CH4 (g)+2O2(g)=CO2(g)+2H2O(l);△H=-802.33kJ/mol,则CH4的燃烧热为802.33 kJ
C.H2(g)+Br2(g)=2HBr(g) △H=-72kJ·mol-1其它相关数据如下表:

则表中a为230
D.已知S (g)+O2(g)=SO2(s);△H1,S (g)+O2(g)=SO2(g);△H2,则△H2<△H1
难度: 中等查看答案及解析