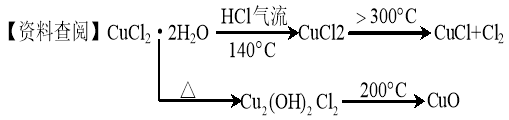
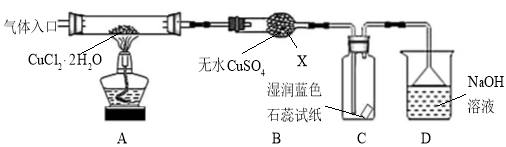
-
化学与生活密切相关,下列有关说法错误的是( )
A.用灼烧的方法可以区分蚕丝和人造纤维
B.食用油反复加热会产生稠环芳香烃等有害物质
C.医用消毒酒精中乙醇的浓度为95%
D.加热能杀死流感病毒是因为蛋白质受热变性
难度: 简单查看答案及解析
-
在密闭容器中进行的反应:N2+O2
2NO,不能加快该反应的反应速率的是( )
A.缩小体积
B.充入少量NO气体
C.体积增大到原来的2倍
D.升高温度
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.需要加热才能发生的反应一定是吸热反应
B.放热反应在常温下一定很容易发生
C.吸热反应不加热不可能进行反应
D.反应是吸热还是放热是由反应物和生成物所具有的总能量的相对大小而决定的
难度: 简单查看答案及解析
-
在已经处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明化学平衡移动的是( )
A.反应混合物的浓度 B.反应体系的压强
C.正、逆反应的速率 D.反应物的转化率
难度: 中等查看答案及解析
-
下列有关物质的性质与用途具有对应关系的是( )
A.SO2具有氧化性,可用于漂白纸浆 B.NH4HCO3受热易分解,可用作氮肥
C.Fe2(SO4)3易溶于水,可用作净水剂 D.Al2O3熔点高,可用作耐高温材料
难度: 中等查看答案及解析
-
下列有关实验的操作正确的是( )
实验
操作
A.
配制稀硫酸
先将浓硫酸加入烧杯中,后倒入蒸馏水
B.
排水法收集KMnO4分解产生的O2
先熄灭酒精灯,后移出导管
C.
浓盐酸与MnO2反应制备纯净Cl2
气体产物先通过浓硫酸,后通过饱和食盐水
D.
CCl4萃取碘水中的I2
先从分液漏斗下口放出有机层,后从上口倒出水层
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.2.4g Mg在足量O2中燃烧,转移的电子数为0.1NA
B.标准状况下,5.6L CO2气体中含有氧原子数为0.5NA
C.氢原子数为0.4NA的CH3OH分子中含有的σ键数为0.4NA
D.0.1L 0.5 mol·L-1 CH3COOH溶液中含有的H+数为0.05NA
难度: 困难查看答案及解析
-
下列物质中,其主要成分不属于烃的是( )
A.汽油 B.甘油 C.煤油 D.柴油
难度: 简单查看答案及解析
-
高温下,某反应达到平衡,平衡常数K=,恒容时,温度升高,H2浓度减小。下列说法正确的是( )
A.该反应的焓变为正值
B.该反应化学方程式为CO+H2O(g)
CO2+H2
C.恒温恒容下,增大压强,H2浓度一定减小
D.升高温度,逆反应速率减小
难度: 简单查看答案及解析
-
下列关于离子共存或离子反应的说法正确的是( )
A.某无色溶液中可能大量存在H+、 Cl- 、MnO4-
B.PH=2 的溶液中可能大量存在Na+ 、 NH4+、SiO32-
C.Fe2+ 与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+=2Fe3++2H2O
D.稀硫酸与Ba(OH)2溶液的反应: H++SO42-+OH-=BaSO4↓+H2O
难度: 简单查看答案及解析
-
已知①2C(s)+ O2(g)=2CO(g);△H=-221.0kJ·mol-1
②2H2(g)+O 2(g)= 2H2O(g); △H=-483.6kJ·mol-1,则制备水煤气的反应
C(s)+H2O(g)= CO(g)+ H2(g); △H为( )
A.+ 262.6 kJ·mol—1
B.-131.3kJ·mol-1
C.-352.3kJ·mol-1
D.+ 131.3 kJ·mol—1
难度: 简单查看答案及解析
-
四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是( )
A. 简单离子半径:W< X<Z
B. W与X形成的化合物溶于水后溶液呈碱性
C. 气态氢化物的热稳定性:W<Y
D. 最高价氧化物的水化物的酸性:Y>Z
难度: 中等查看答案及解析
-
航天燃料从液态变为固态,是一项技术突破。铍是高效率的火箭材料,燃烧时放出巨大的能量,每千克的铍完全燃烧放出的热量为62 700 kJ。则铍燃烧的热化学方程式正确的是( )
A.Be+
O2===BeO ΔH=-564.3 kJ·mol-1
B.Be(s)+
O2(g)===BeO(s)ΔH=+564.3 kJ·mol-1
C.Be(s)+
O2(g)===BeO(s)ΔH=-564.3 kJ·mol-1
D.Be(s)+
O2(g)===BeO(g)ΔH=-564.3 kJ
难度: 中等查看答案及解析
-
O2F2可以发生反应:H2S+4O2F2→SF6+2HF+4O2,下列说法正确的是( )
A.氧气是氧化产物
B.还原剂与氧化剂的物质的量之比为1:4
C.若生成4.48 L HF,则转移0.8 mol电子
D.O2F2既是氧化剂又是还原剂
难度: 困难查看答案及解析
-
在一定温度和体积下,反应A2(g)+ B2 (g)
2AB(g)达到平衡的标志是( )
A.单位时间生成n mol A2同时生成n mol AB
B.容器内总压不随时间变化
C.单位时间生成2n mol AB同时生成n mol B2
D.混合气体的平均相对分子质量不随时间变化
难度: 中等查看答案及解析
-
热化学方程式:S(g)+O2(g)
SO2(g) △H=-297.3 kJ·mol-1,分析下列说法中正确的是( )
A.S(g)+O2(g)=SO2(l) |△H|<297.3 kJ·mol-1
B.1molSO2的键能总和大于1molS和1molO2键能之和
C.S(s)+O2(g)=SO2(l) |△H|> 297.3 kJ·mol-1
D.1molSO2的键能总和小于1molS和1molO2键能之和
难度: 中等查看答案及解析
-
在容积可变的密闭容器中,2 mol N2和8 mol H2在一定条件下反应,达到平衡时,H2的转化率为25%,则平衡时氨气的体积分数接近于( )
A.5% B.10% C.15% D.20%
难度: 简单查看答案及解析
-
已知2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
C3H8(g)+5O2(g)===3CO2(g)+4H2O(l)ΔH=-2 220 kJ·mol-1
设有氢气和丙烷的混合气体5 mol,完全燃烧时放出热量3847 kJ,则混合气体中氢气和丙烷的体积比是( )
A.1∶3 B.3∶1 C.1∶4 D.1∶1
难度: 简单查看答案及解析
-
反应N2O4(g)
2NO2(g)ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )

A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.A、C两点气体的平均相对分子质量:A>C
D.由状态B到状态A,可以用加热的方法
难度: 中等查看答案及解析