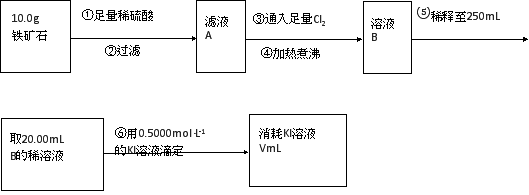
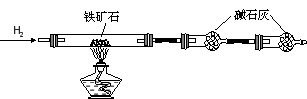-
下列说法正确的是 ( )
A.从海水中提取物质都必须通过化学反应才能实现
B.二氧化硫可用于消毒杀菌和漂白纸张草帽等
C.过氧化钠、烧碱、纯碱分别属于碱性氧化物、碱、盐
D.Na、Al、Cu可以分别用热还原法、热分解法和电解冶炼法得到
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的数值,下列说法不正确的是 ( )
A.2.3g金属钠与过量的氧气反应,无论加热与否转移电子数均为0.1NA
B.1molNa2CO3晶体中含CO32ˉ数目一定为NA
C.常温常压下,92g的NO2和N2O4混合气体中含有原子数为6 NA
D.惰性电极电解食盐水,若电路中通过NA个电子,则阳极产生气体11.2L
难度: 中等查看答案及解析
-
某课外实验小组设计的下列实验合理的是 ( )
A
B
C
D
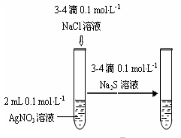
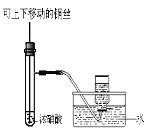
装置能验证AgCl沉淀可转化为溶解度更小的Ag2S沉淀 制备少量氨气 制备并收集少量NO2气体 制备少量氧气
难度: 中等查看答案及解析
-
归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:(均在常温下)
① pH =1的强酸溶液,加水稀释后,溶液中所有离子的浓度均降低
② pH=2的盐酸和pH=1的醋酸,c(H+)之比为2∶1
③在等物质的量浓度、等体积的氯化铵和氨水的混合溶液中存在下列关系c(NH4+)+2c(H+) =2c(OH-)+ c(NH3·H2O)
④反应2A (s) + B (g)=2C (g) + D (g) 不能自发进行,则该反应△H一定大于0
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw 则三者关系为:Ka·Kh=Kw
⑥ 反应A(g)
2B(g);若正反应的活化能为Ea kJ·mol-1,逆反应的活化能为Eb kJ·mol-1,则该反应的△H =(Ea -Eb)kJ·mol-1。其归纳正确的是 ( )
A.①③⑤⑥ B.③④⑤⑥ C.②④⑤⑥ D.①③④⑤
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式是 ( )
A.Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O
B.NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O
C.将过量的SO2通入Ca(ClO)2溶液中: SO2+ClO-+H2O =HClO+ HSO3-
D.将0.2 mol·L-1的NH4Al(SO4)2溶液与0.3 mol·L-1的Ba(OH)2溶液等体积混合:
2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
难度: 困难查看答案及解析
-
常温常压下,将a mol CO2气体通入1L bmol/L的NaOH溶液中,下列对所得溶液的描述不正确的是( )
A.当1/2<a/b<1时,所得溶液中一定存在:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
B.当a=b时,所得溶液中存在:c(OH-)+c(CO32-)=c(H+)+c(H2CO3)
C.当a/b=2/3时,所得溶液中存在:3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
D.当2a=b时,所得溶液中存在:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
难度: 中等查看答案及解析