-
已知短周期元素的离子.aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
A.原子半径A>B>D>C
B.a-c=1
C.离子半径C>D>B>A
D.单质的还原性A>B>D>C难度: 中等查看答案及解析
-
在298K、100kPa时,已知:
2H2O(g)═2H2(g)+O2(g)△H1
H2(g)+Cl(g)═2HCl(g)△H2
2Cl2(g)+2H2O(g)═4HCl(g)+O2(g)△H3
则△H3与△H1和△H2间的关系正确的是( )
A.△H3=△H1+2△H2
B.△H3=△H1+△H2
C.△H3=△H1-2△H2
D.△H3=△H1-△H2难度: 中等查看答案及解析
-
2006年9月份,“SK-Ⅱ”化妆品事件一时闹得沸沸扬扬.其实,从毒韭菜到炸鸡翅、从儿童奶粉到“瘦肉精”事件,化学性污染事件报道层出不穷,其中尤以食品安全最为引人恐慌.如食品报道中不断有①“致癌农药”、②“苏丹红”、③“碘元素”、④“亚硝酸盐”等化学名词出现.上述化学名词所提到的物质中,在某食品添加剂中允许含有但符合限量时不会引起中毒的是( )
A.②③④
B.②③
C.③④
D.②④难度: 中等查看答案及解析
-
某有机物的结构可用键线式(如图所示)表示,下列有关该有机物的说法正确的是( )
A.该有机物的分子式为C8H10
B.该有机物能使酸性KMnO4溶液褪色
C.乙苯、二甲苯都是该有机物的同分异构体
D.1mol该有机物可最多能与2molBr2发生加成反应难度: 中等查看答案及解析
-
已知酸性条件下有如下反应:2Cu+=Cu2++Cu.由于反应温度不同,用氢气还原氧化铜时,可能产生Cu或Cu2O,两者都是红色固体.一同学对某次用氢气还原氧化铜实验所得的红色固体产物作了验证,实验操作和实验现象记录如下
由此推出本次氢气还原氧化铜实验的产物是( )加入试剂 稀硫酸 浓硫酸、加热 稀硝酸 浓硝酸 实验现象 红色固体
和蓝色溶液无色气体 无色气体
和蓝色溶液红棕色气体
和绿色溶液
A.Cu
B.Cu2O
C.一定有Cu,可能有Cu2O
D.一定有Cu2O,可能有Cu难度: 中等查看答案及解析
-
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强,无二次污染的绿色水处理剂.工业制高铁酸钠的方法有如下两种:
①湿法制备的主要反应方程式为:Fe(OH)3+ClO-+OH-→FeO42-+Cl-+H2O
②干法制备的主要反应方程式为:FeSO4+Na2O2→Na2FeO4+Na2O+Na2SO4+O2↑
(均未配平)下列有关说法不正确的是( )
A.高铁酸钠中铁显+6价
B.湿法制备的反应方程式中,氧化剂和还原剂的物质的量之比为3:2
C.干法中每生成1molNa2FeO4转移4mol电子
D.K2FeO4处理水时,不仅能消毒杀菌,还能除去水体中的H2S、NH3等,生成的Fe(OH)3还能吸附水中的悬浮杂质难度: 中等查看答案及解析
-
下述实验能达到预期目的是( )
A.实验内容:将SO2通入酸性KMnO4溶液中;实验目的:证明SO2具有漂白性
B.实验内容:测同物质的量浓度H2SO4和HIO3溶液的pH;实验目的:比较硫与碘元素的非金属性强弱
C.实验内容:将铜与浓硝酸反应生成的气体收集后用冰水混合物冷却降温;实验目的:研究温度对化学平衡的影响
D.实验内容:向某无色溶液中滴加酚酞试液;实验目的:确定该溶液为碱溶液难度: 中等查看答案及解析
-
下列反应的离子方程式书写错误的是( )
A.向饱和Ca(HCO3)2溶液中加入过量的石灰水:Ca2++HCO3-+OH-=CaCO3↓+H2O
B.次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO
C.1L2mol/L的FeBr2溶液中通入2.5molCl2:4Fe2++6Br-+5Cl2═10Cl-+4Fe3++3Br2
D.苯酚钠溶液中通入少量CO2:C6H5O-+CO2+H2O═C6H5OH↓+HCO3-难度: 中等查看答案及解析
-
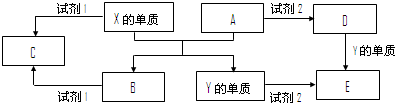
A是一种常见的单质,B、C为中学化学常见的化合物,A、B、C均含有元素X.它们有如图所示的转化关系(部分产物及反应条件已略去):下列说法中不正确的是( )
A.X元素可能为Al
B.X元素一定为非金属元素
C.A可能是Cl2
D.反应①和②一定为氧化还原反应难度: 中等查看答案及解析
-
在一定条件下,已知一个氢原子失去一个电子需吸收akJ能量,同一条件下有以下说法,其中正确的是( )
A.一个H2失去2个电子需吸收2akJ能量
B.H+H→H2,会放出2akJ的能量
C.一个H+得到一个电子需吸收akJ的能量
D.一个H+得到一个电子会放出akJ的能量难度: 中等查看答案及解析
-
镓是1871年俄国化学家门捷列夫在编制元素周期表时曾预言的“类铝”元素,镓的原子序数为31,属ⅢA元素,镓的熔点为29.78℃,沸点高达2403℃,镓有过冷现象(即冷至熔点以下不凝固),它可过冷到-120℃.下列有关镓的性质及其用途的叙述不正确的是( )
A.镓是制造高温温度计的上佳材料
B.镓能溶于强酸或强碱溶液中
C.镓与锌、锡等金属制成合金,可提高其硬度
D.镓可用于制造半导体材料,这是因为镓的导电性介于导体和绝缘体之间难度: 中等查看答案及解析
-
下列各种溶液中,一定能大量共存的离子组是( )
A.pH=0的溶液中:Fe2+、NO3-、SO42-、I-
B.由水电离的c(H+)=10-14mol•L-1的溶液中:K+、Na+、SO42-、Cl-
C.加入Al粉会产生无色无味气体的溶液中:Na+、Cu2+、NO3-、SO42-
D.使紫色石蕊液变红色的溶液中:Na+、AlO2-、S2-、SO42-难度: 中等查看答案及解析
-
若设NA=1mol×6.02×1023mol-1,下列叙述中正确的是( )
A.将162.5gFeCl3转化为氢氧化铁胶体后,氢氧化铁胶体粒子数等于NA
B.标准状况下,22.4LCCl4中碳原子的个数约为NA
C.含有NA个氖原子的氖气在标准状况下的体积约为11.2L
D.标准状况下,用NaOH溶液吸收氯气22.4L,反应中转移的电子数目为NA难度: 中等查看答案及解析
-
下列叙述中正确的是( )
A.体积相同、浓度均为0.1mol/L的NaOH溶液、氨水,分别稀释m倍、n倍,溶液的pH都变成9,则m<n
B.有甲、乙两醋酸溶液,测得甲的pH=a,乙的pH=a+1,若用于中和等物质的量浓度等体积的NaOH溶液,需甲、乙两酸的体积V(乙)>10V(甲)
C.25℃,pH=9的NaOH溶液和NaAc溶液中,由水电离出的c(H+)均为10-5mol•L-1
D.c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)该式只能满足NaHCO3溶液中的离子浓度关系难度: 中等查看答案及解析
-
一定条件下将质量为X g的有机物在O2中完全燃烧,燃烧后全部产物通过足量Na2O2层,过氧化钠的质量增重Y g,下列对应关系一定正确的是( )
序号 有机物 X Y A C2H4O2 m B HCOOH m C CH3OH和CH3COOH的混合物 m D HCOOH与CH3COOCH3的混合物 m 2m
A.A
B.B
C.C
D.D难度: 中等查看答案及解析