-
如果你家里的食用花生油混有水份,你将采用下列何种方法分离
A.过滤 B.蒸馏 C.分液 D.萃取
难度: 简单查看答案及解析
-
下列状态的物质,既能导电又属于电解质的是
A.NaCl溶液 B. 液态 HCl C. 熔融的KOH D. 蔗糖溶液
难度: 简单查看答案及解析
-
下列叙述中正确的是
A.含最高价元素的化合物,一定具有强氧化性
B.阳离子只有氧化性,阴离子只有还原性
C.失电子越多,还原性越强
D.强氧化剂与强还原剂不一定能发生氧化还原反应
难度: 简单查看答案及解析
-
下列实验中均需要的仪器是
①配制一定物质的量浓度的溶液 ②PH试纸的使用 ③过滤 ④蒸发
A.试管 B.胶头滴管 C.玻璃棒 D.漏斗
难度: 简单查看答案及解析
-
在3Cl2+6KOH= KClO3+5KCl+3H2O的反应中,氧化剂和还原剂的质量比是
A.1:5 B.5:1 C.1:1 D.2:1
难度: 简单查看答案及解析
-
FeCl3溶液与Fe(OH)3胶体具有共同的性质是
①分散质颗粒直径在1—100nm之间 ②能通过滤纸
③都是透明的 ④呈红褐色
A.①② B.②③ C.③④ D.②④
难度: 简单查看答案及解析
-
关于同温、同压下等体积的N2O和CO2的叙述:①质量相同;②所含碳原子数与氮原子数相等;③所含分子数相等,其中正确的是
A.①②③ B.②③ C.①② D.①③
难度: 简单查看答案及解析
-
对于反应:H-+NH3=H2+NH
的说法正确的是
A.该反应属于置换反应
B.NH3是氧化剂
C.NH
是还原产物
D.若反应中有1 mol电子转移,则必然生成22.4 L H2
难度: 简单查看答案及解析
-
化学概念在逻辑上存在下图所示关系:对下列概念的说法正确的是
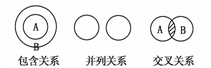
A.纯净物与混合物属于包含关系
B.化合物与氧化物属于包含关系
C.单质与化合物属于交叉关系
D.氧化还原反应与化合反应属于并列关系
难度: 简单查看答案及解析
-
实验是化学研究的基础,关于下列各实验装置图的叙述中,错误的是
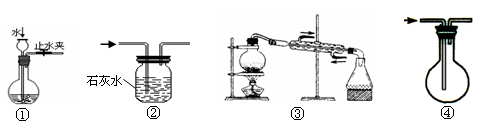
A.装置①可用于检查装置的气密性
B.装置②可用于除去CO中混有的少量CO2
C.装置③可用于从海水中得到淡水
D.装置④ 可用于排空气收集CO
难度: 简单查看答案及解析
-
实验室里需用480 mL 0.1 mol/L的硫酸铜溶液,现选取500 mL容量瓶进行配制,以下操作正确的是
A.称取7.68g硫酸铜,加入500 mL水
B.称取12.0g胆矾配成500 mL溶液
C.称取8.0g硫酸铜,加入500 mL水
D.称取12.5g胆矾配成500 mL溶液
难度: 简单查看答案及解析
-
在酸性无色透明溶液中能大量共存的离子组是
A. Al3+、Ag+、NO3-、Cl- B. Mg2+、NH4+、NO3-、Cl-
C. Cu2+、K+、SO42-、Cl- D. Ca2+、Na+、NO3-、CO3
难度: 简单查看答案及解析
-
以NA表示阿佛加德罗常数,下列说法中正确的是
A.53g碳酸钠中含NA个CO32-
B.0.1molOH-含0.9NA个电子
C.18g水(H2O)中含3NA个原子
D.标准状况下11.2L臭氧中含NA个氧原子
难度: 简单查看答案及解析
-
下列反应的离子方程式书写正确的是
A.用NaOH溶液吸收少量CO2 : CO2+OH-=CO32-+H2O
B.盐酸滴在铜片上 : Cu+2H+=Cu2++H2O
C.H2SO4与Ba(OH)2溶液反应 :
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
D.CaCl2溶液中通入CO2 : Ca2++ CO2+ H2O=CaCO3↓+2H+
难度: 简单查看答案及解析
-
等质量的CuO和MgO粉末分别溶于相同体积的足量硝酸中,得到的Cu(NO3)2和Mg(NO3)2溶液的浓度分别为amol·L-1和bmol· L-1(忽略溶液体积变化)。则a与b的关系为
A.a=b B.a=2b
C.2a=b D.无法确定
难度: 简单查看答案及解析
-
能用离子方程式 CO32-+ 2H+ =CO2 ↑+ H2O表示的反应是
A. Na2CO3 + 2HCl═ 2NaCl + CO2 ↑+ H2O
B. NaHCO3 + HCl ═ NaCl + CO2 ↑+ H2O
C. K2CO3 + 2CH3COOH═2CH3COOK+ CO2 ↑+ H2O
D. CaCO3 + 2HNO3 ═ Ca(NO3)2 + CO2 ↑+ H2O
难度: 简单查看答案及解析
-
为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,得到纯净的NaCl,可将粗盐溶于水,然后在下列操作中选取必要的步骤和正确的操作顺序:
①过滤; ②加过量NaOH溶液; ③加适量盐酸;
④加过量Na2CO3溶液 ⑤加过量BaCl2溶液
A.④②⑤ B.④①②⑤③ C.②⑤④①③ D.①④②⑤
难度: 简单查看答案及解析
-
在烧杯中加入水和煤油(密度:0.88 g/cm3)各50 mL,将一小粒金属钠(密度:0.97 g/cm3)投入烧杯中,观察到的现象可能是
A.钠在水层中反应并四处游动
B.钠停留在煤油层中不发生反应
C.钠在煤油的液面上反应并四处游动
D.钠在煤油与水的界面处反应并可能作上、下跳动
难度: 简单查看答案及解析
-
有BaCl2和NaCl的混合溶液aL,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl
离子完全沉淀。反应中消耗xmol H2SO4、ymol AgNO3。据此得知原混合溶液中的c(Na+)/ mol·L-1为
A.(y-2x)/a B.(y-x)/a C.(2y-2x)/a D.(2y-4x)/a
难度: 简单查看答案及解析
-
已知溶质的质量分数为95%的酒精溶液的物质的量浓度为16.52 mol·L-1,试判断溶质的质量分数为47.5%的酒精溶液的物质的量浓度
A.大于8.26 mol·L-1 B.等于8.26 mol·L-1
C.小于8.26 mol·L-1 D.无法判断
难度: 简单查看答案及解析