-
能源问题是人类生存和社会发展的重要问题,下列关于能源问题的说法正确的是( )
A. 氢气是具有热值高、无污染等优点的燃料
B. 采用新技术开采煤、石油和天然气,以满足经济发展的需要
C. 煤燃烧是化学能只转化为热能的过程
D. 风能是太阳能的一种转换形式,所以风能属于二次能源
难度: 简单查看答案及解析
-
下列各项比较错误的是( )
A. 微粒半径:r(Na+)>r(Mg2+)>r(Al3+)
B. 酸性强弱:H2SiO3<H2CO3<H2SO4
C. 沸点:H2O>H2S>H2Se
D. 碱性强弱:NaOH>Mg(OH)2>Al(OH)3
难度: 中等查看答案及解析
-
下列关于硅及二氧化硅的说法中正确的是( )
A. 高纯度的硅可用于制造计算机芯片 B. SiO2的物理性质与CO2类似
C. 熔融烧碱样品使用的器皿是石英坩埚 D. 光导纤维的主要成分是Si
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中可能大量共存的是( )
A. 无色透明的溶液中:Fe3+、Mg2+、SO42﹣、Cl﹣
B. 由水电离产生的c(OH﹣)=1×10﹣12mol/L的溶液中:NO3﹣、K+、Na+、SO42﹣
C. 含有大量Fe3+的溶液中:Al3+、SCN﹣、Br﹣、Na+
D. 能使甲基橙变红的溶液中:Na+、NH4+、SO42﹣、HCO3﹣
难度: 简单查看答案及解析
-
已知反应 2SO2(g)+O2(g)⇌2SO3(g)△H<0,下列说法正确的是( )
A. 升高温度,正反应速率减慢,逆反应速率加快,化学平衡逆向移动
B. 增大压强,化学平衡正向移动
C. 充入O2,可提高O2的转化率
D. 当气体密度不变时,反应达平衡状态
难度: 中等查看答案及解析
-
下列说法中,正确的是( )
A. 在BaC12溶液中通入SO2气体,溶液仍澄清,滴入3%过氧化氢溶液有白色沉淀
B. 可以用澄清石灰水来鉴别SO2与CO2
C. 硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物是三氧化硫
D. SO2能使溴水褪色,体现SO2的漂白性
难度: 中等查看答案及解析
-
某纯碱厂技术科的人员对该厂纯碱样品的质量进行检验。其中能够说明纯碱样品中可能含有杂质(NaHCO3)的实验是( )
①样品溶于水,并加入足量的澄清石灰水,变浑浊
②样品溶于水,并加入足量的BaCl2溶液,变浑浊
③样品在硬质试管中加强热,排出的气体通入澄清石灰水,变浑浊
④向样品中滴加稀盐酸,排出的气体通入澄清石灰水,变浑浊
A. ①②③ B. ①③④ C. ①②④ D. 只有③
难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A. Fe3O4固体溶于足量稀硝酸溶液中:Fe3O4+8H+═2Fe3++Fe2++4H2O
B. 用小苏打治疗胃酸过多:HCO3﹣+H+═CO2↑+H2O
C. 向溴化亚铁溶液中通入足量氯气:2Br﹣+Cl2═Br2+2Cl﹣
D. 碳酸氢铵溶液与足量澄清石灰水溶液混合:2HCO3﹣+Ca2++2OH﹣═CaCO3↓+CO32﹣+2H2O
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值.下列叙述不正确的是( )
A. 2molSO2和1molO2在一定条件下充分反应后,所得混合气体的分子数大于2NA
B. 0.05mol熔融的NaHSO4中含有的阳离子数为0.05NA
C. O2和O3的混合物共3.2g,其中所含氧原子数一定为0.2NA
D. 5.6gFe和足量盐酸完全反应,转移的电子数为0.3NA
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 甲烷的标准燃烧热为△H=﹣890.3kJ•mol﹣1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=﹣890.3 kJ•mol﹣1
B. 从C(石墨)═C(金刚石)△H=+1.9kJ/mol,可知石墨比金刚石更稳定
C. 常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H<0
D. HCl和NaOH反应的中和热△H=﹣57.3 kJ•mol﹣1 , 则H2SO4和Ba(OH)2反应热△H=2×(﹣57.3)kJ•mol﹣1
难度: 简单查看答案及解析
-
赤铜矿的主要成分是氧化亚铜(Cu2O),辉铜矿的主要成分是硫化亚铜(Cu2S),将赤铜矿与辉铜矿混合加热有如下反应:Cu2S+2Cu2O=6Cu+SO2↑,下列对于该反应的说法正确的是( )
A. 该反应中的氧化剂只有Cu2O B. Cu既是氧化产物又是还原产物
C. Cu2S在反应中只做还原剂 D. 氧化产物与还原产物的物质的量之比为1:6
难度: 简单查看答案及解析
-
化学是一门实用性的学科,以下叙述正确的是( )
A. 静置后的淘米水能产生丁达尔现象,这种“淘米水”是胶体
B. “洁厕灵”有效成分为盐酸,与漂白粉混合使用效果更佳
C. 活泼金属的冶炼常用电解方法,如电解NaCl溶液就可制备Na
D. 铝热反应中可得到铁,工业上可以利用该反应来大量生产铁
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是( )
A. 2016年命名的含有173个中子的113号元素:
Nh
B. 次氯酸的结构式:H﹣Cl﹣O
C. CSO的电子式:
D. 碳酸的电离:H2CO3⇌2H++CO32﹣
难度: 简单查看答案及解析
-
X、Y、Z、W、M 为原子序数依次增大的短周期主族元素。已知:①元素对应的原子半径大小为:X<Z<Y<M<W;② Y 是组成有机物的必要元素 ③ Z 与 X 可形成两种常见的共价化合物,与 W 可形成两种常见的离子化台物;④ M 的电子层数与最外层电子数相等。下列说法不正确的是
A. W、M 的原子半径为 M<W
B. YZ2为直线形的共价化合物,W2Z2既含有离子键又含有共价键
C. Z 与 X 形成的化合物的熔沸点偏高是因其分子内存在氢键
D. Z 与 M 形成的化合物可作为耐高温材料
难度: 中等查看答案及解析
-
下图为生锈了的家用铁锅,下列有关解释事实的方程式不正确的是

A. 铁锅生锈过程中有原电池反应,负极反应式是:Fe—2e—= Fe2+
B. 铁锅生锈过程中有 Fe(OH)3生成:Fe3+ + 3H2O
Fe(OH)3 + 3H+
C. 摄入体内的铁锈会在胃内产生不利于健康的Fe3+:Fe2O3 + 6H+=2Fe3++3H2O
D. 用醋可除去铁锈:6CH3COOH + Fe2O3 =6CH3COO—+ 2Fe3+ + 3H2O
难度: 中等查看答案及解析
-
仅根据题中图示得出的结论不合理的是
选项
A
B
C
D
图示
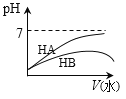

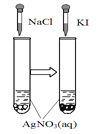
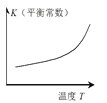
结论
HB为弱酸
HF为弱电解质
溶解度:AgI< AgCl
正反应△H>0
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下面提到的问题中,与盐的水解有关的是( )
①明矾和FeCl3可作净水剂
②为保存FeCl3溶液,要在溶液中加少量盐酸
③实验室配制AlCl3溶液时,应先把它溶解在盐酸中,而后加水稀释
④NH4Cl溶液可作焊接中的除锈剂
⑤实验室盛放Na2SiO3溶液的试剂瓶应用橡皮塞,而不能用玻璃塞
⑥用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
⑦在NH4Cl或AlCl3溶液中加入金属镁会生成氢气
⑧草木灰与铵态氮肥不能混合施用
⑨加热蒸干AlCl3溶液得到Al(OH)3固体.
A. ①④⑦ B. ②⑤⑧ C. ③⑥⑨ D. 全部
难度: 中等查看答案及解析
-
室温下,用0.100mol•L﹣1 NaOH溶液分别滴定20.00mL 0.100mol•L﹣1的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )
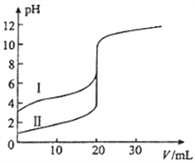
A. Ⅱ表示的是滴定醋酸的曲线
B. pH=7时,滴定醋酸消耗的V(NaOH)小于20mL
C. V(NaOH)=20.00mL时,两份溶液中c(Cl﹣)=c(CH3COO﹣)
D. V(NaOH)=10.00mL时,醋酸溶液中c(Na+)>c(CH3COO﹣)>c(H+)>c(OH﹣)
难度: 简单查看答案及解析