-
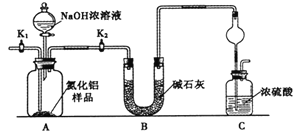
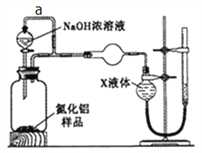
中国丝绸有五千年的历史和文化,古代中国丝绸有五千年的历史和文化。古代染坊常用某种“碱剂”来精炼丝绸,该“碱剂”的主要成分是一种盐,能促进蚕丝表层的丝胶蛋白质水解而除去,使丝绸颜色洁白、质感柔软、色泽光亮。这种“碱剂”可能是
A. 食盐 B. 火碱 C. 草木灰 D. 胆矾
难度: 中等查看答案及解析
-
下列说法中正确的是
①钠在空气中燃烧生成淡黄色的Na2O2 ②常温下铝制容器可储运浓硫酸或浓硝酸 ③盐酸既有氧化性又有还原性 ④Fe(OH)3、FeCl2、H2SiO3都不能直接用化合反应制备 ⑤SO2能使酸性高锰酸钾溶液褪色,所以它具有漂白性
A. ②③ B. ①②③ C. ①②③④ D. ①②③⑤
难度: 中等查看答案及解析
-
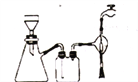
按以下实验方案可以从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物。
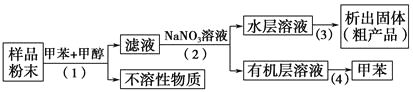
下列说法错误的是
A. 步骤(1)需要过滤装置 B. 步骤(2)需要用到分液漏斗
C. 步骤(3)需要用到坩埚 D. 步骤(4)需要蒸馏装置
难度: 中等查看答案及解析
-
下列说法中,错误的是
A. 将海水蒸馏可以得到淡水
B. 萃取实验中需要分液操作
C. 可以用过滤的方法分离NaCl溶液和植物油
D. 除去硝酸钾固体中的少量氯化钠可以将混合物制成热饱和溶液,冷却结晶,过滤
难度: 简单查看答案及解析
-
下表中有关离子方程式的评价合理的是
选项
化学反应及离子方程式
评价
A
AlCl3溶液中加入过量氨水:
Al3++3NH3·H2O=Al(OH)3↓+3NH4+
错误,铝元素的产物应该是AlO2-
B
等物质的量的氯气通入溴化亚铁溶液中:
3Cl2+2Fe2++4Br-=6Cl-+2Fe3++2Br2
正确
C
用氨水吸收过量二氧化硫:
2 NH3·H2O+SO2=2NH4++SO32-+H2O
正确
D
氯化铵溶于水NH4++2H2O=H3O++ NH3·H2O
错误,应该用可逆符号
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列各组离子在通入SO2前后均能大量共存的是
A. Ba2+、K+、Br-、Cl- B. Na+、Cu2+、OH-、SiO32-
C. NH4+、Al3+、Br-、AlO2- D. Li+、H+、NO3-、SO42-
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A. 次氯酸溶液中通入少量二氧化硫气体: 2ClO-+SO2+H2O═SO32-+2HClO
B. Fe(NO3)2溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2
C. 向KI与稀硫酸的混合溶液中通入氧气:4H++O2+4I-=2I2+2H2O
D. NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+ 2H2O+ CO32-
难度: 中等查看答案及解析
-
化学与生活密切相关。下列说法不正确的是
A. 乙烯可作水果的催熟剂
B. 硅胶可作袋装食品的干燥剂,铁粉可做脱氧剂
C. 福尔马林可作食品的保鲜剂
D. 氢氧化铝可作胃酸的中和剂
难度: 简单查看答案及解析
-
NA表示阿伏伽德罗常数,下列叙述正确的是
A. 1mol FeI2与足量氯气反应时转移的电子数为2NA
B. 2L 0.5mol/L硫酸钾溶液中阴离子所带电荷数为NA
C. 1mol Na2O2固体中含离子总数为4NA
D. 丙烯和环丙烷组成的42g混合气体中氢原子的个数为6NA
难度: 困难查看答案及解析
-
下列各组离子能大量共存的是
A.NaClO水溶液中:Fe2+、Cl-、Ca2+、H+
B.加入KSCN显红色的溶液:K+、Na+、I-、S2-
C.无色酸性溶液中:K+、CH3COO-、HCO3-、MnO4-
D.pH=2的溶液中:NH4+、Na+、Cl-、Cu2+
难度: 困难查看答案及解析
-
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是
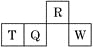
A. 最简单气态氢化物的热稳定性:R>Q
B. 最高价氧化物对应水化物的酸性:Q<W
C. 原子半径:T>Q>R
D. 含T的盐溶液一定显酸性
难度: 中等查看答案及解析
-
中学化学中很多“规律”都有其适用范围,据有关“规律”下列结论合理的
A. 根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO
B. 金属镁可以通过电解MgCl2制得,推出金属铝可以通过电解AlCl3制得
C. 金属钠在纯氧中燃烧生成Na2O2,推出金属锂在纯氧中燃烧生产Li2O2
D. CaCO3与稀硝酸反应生成CO2,推出CaSO3也能与稀硝酸反应生成SO2
难度: 中等查看答案及解析
-
下列有关说法正确的有
①用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗上口倒出 ②过滤操作中,漏斗的尖端应接触烧杯内壁③测氯水的pH,可用玻璃棒蘸取氯水点在pH试纸上,待其变色后,与标准比色卡比较④蒸发操作时,蒸发皿必须放在石棉网上,并用酒精灯的外焰加热⑤配制一定浓度的稀硫酸,用量筒量取浓硫酸后,未将蒸馏水洗涤量筒后的洗涤液转移至容量瓶中,使配制的溶液浓度偏小⑥石油的蒸馏实验中,忘记加沸石,可以先停止加热,待溶液冷却后加入沸石,再继续加热蒸馏
A. 2句 B. 3 句 C. 4句 D. 5句
难度: 中等查看答案及解析
-
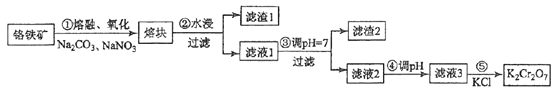
中科院化学所研制的晶体材料——纳米四氧化三铁,在核磁共振造影及医药上有广泛用途,其生产过程的部分流程如下:

下列有关叙述不合理的是
A. 纳米四氧化三铁可分散在水中,它与FeCl3溶液的分散质直径相当
B. 纳米四氧化三铁具有磁性,可作为药物载体用于治疗疾病
C. 在反应①中环丙胺的作用可能是促进氯化铁水解
D. 反应②的化学方程式是6FeOOH +CO=2Fe3O4+3H2O+CO2
难度: 简单查看答案及解析
-
根据下列实验操作和现象所得出的结论不正确的是
选项
实验操作
实验现象
结论
A
向某溶液中加入稀氢氧化钠溶液后,将湿润的红色石蕊试纸放在试管口
试纸没有变蓝色
溶液中不含NH4+
B
溴乙烷与NaOH溶液供热后,加HNO3酸化,再加AgNO3溶液
出现淡黄色沉淀
溴乙烷发生了水解
C
Mg(OH)2悬浊液中加入pH=7的醋酸铵溶液
沉淀溶解
加入醋酸铵发生
NH4++OH-
NH3·H2O
使Mg(OH)2Mg2++2OH-平衡向右移动
D
洁净的铁钉在浓硝酸中浸泡片刻,蒸馏水冲洗后,再加入CuSO4溶液
铁钉表面无红色物质生成
铁钉在浓硝酸中已钝化
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
Na2FeO4是一种高效多功能水处理剂,应用前景十分看好。一种制备Na2FeO4的方法可用化学方程式表示如下: 2FeSO4+6Na2O2==2Na2FeO4+2Na2O+2Na2SO4+O2↑, 对此反应下列说法中正确的是
A. 2 mol FeSO4发生反应时,反应中共有10 mol电子转移
B. 每生成16g氧气就有1molFe2+被还原
C. Na2O2只作氧化剂
D. 氧化产物只有Na2FeO4
难度: 中等查看答案及解析