-
下列有关性质的比较,不能用元素周期律解释的是
A.酸性:H2SO4>H3PO4 B.热稳定性:Na2CO3>NaHCO3
C.碱性:NaOH>Mg(OH)2 D.非金属性:Cl>Br
难度: 中等查看答案及解析
-
下列有关同分异构体数目的叙述中,错误的是
A.C8H10中只有4种属于芳香烃的同分异构体
B.CH3CH2CH2CH3光照下与氯气反应,生成2种一氯代烃
C.戊烷有3种同分异构体
D.甲苯苯环上的一个氢原子被-C3H7取代,所得产物有3种
难度: 中等查看答案及解析
-
下列说法不正确的是
A.焓变是一个反应能否自发进行的相关因素,多数放热反应能自发进行
B.一个反应能否自发进行,与焓变和熵变的共同影响有关
C.在同一条件下不同物质有不同的熵值,其体系的混乱程度越大,熵值越大
D.自发进行的反应一定能迅速进行
难度: 简单查看答案及解析
-
下列叙述正确的是
A.pH=2的硫酸溶液中c(H+):c(OH-)等于2:1,稀释100倍后二者的比值几乎不变
B.由水电离的c(H+)=10-12mol/L的溶液中K+、Ba2+、Cl-、Br-、HCO3-一定能大量共存
C.1.0×10-3mol/L盐酸溶液的pH=3,则1.0×10-8mol/L盐酸溶液的pH=8
D.某温度下水的离子积为1.0×10-12,若使pH=1的H2SO4溶液与pH=12的NaOH溶液混合后溶液呈中性,则两者的体积比为1:10
难度: 中等查看答案及解析
-
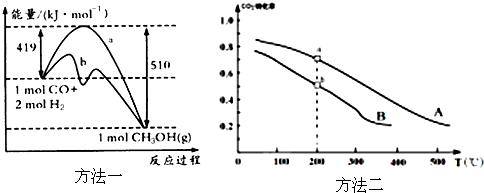
最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:

下列说法中正确的是
A.CO和O生成CO2是吸热反应
B.在该过程中,CO断键形成C和O
C.CO和O生成了具有极性共价键的CO2
D.状态Ⅰ →状态Ⅲ表示CO与O2反应的过程
难度: 中等查看答案及解析
-
下列溶液一定呈中性的是
A.pH=7的溶液
B.c(OH-)=
C.由强酸、强碱等物质的量反应得到的溶液
D.强电解质溶于水得到的溶液
难度: 中等查看答案及解析
-
将浓度为0.1mol/LHF溶液加水不断稀释,下列说法正确的是
A.HF的电离平衡正向移动,c(H+)增大
B.HF的电离程度增大,c(H+)、c(F-)增大,c(HF)减小,则
增大
C.稀释过程中,c(OH-)、
均增大
D.溶液的KW、
、pH均不变
难度: 中等查看答案及解析
-
某小组在某温度下测定溶液的pH时发现,0.01mol/L的NaOH溶液中,c(H+)·c(OH-)=10-12(mol/L)2,则该小组在该温度下测得0.1mol/LNaOH溶液和0.1mol/LHCl溶液pH应为
A.13、1 B.13、2 C.11、1 D.10、2
难度: 中等查看答案及解析
-
在硫化氢的水溶液中,存在以下平衡:H2S
HS-+H+、HS-
H++S2-,若使溶液的pH减小,则c(S2-)
A.增大 B.减小 C.不变 D.可能增大也可能减小
难度: 中等查看答案及解析
-
室温下,甲、乙两烧杯均盛有5mLpH=3的某一元酸溶液,向乙烧杯中加水稀释至pH=4。关于甲、乙两烧杯中溶液的描述不正确的是
A.溶液的体积:10V甲≤V乙
B.水电离出的OH-浓度:10c(OH-)甲=c(OH-)乙
C.若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲≤乙
D.若分别与5mLpH=11的NaOH溶液反应,所得溶液可能显酸性
难度: 中等查看答案及解析
-
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2+6C+2N2
Si3N4+6CO。下列叙述不正确的是
A.若已知上述反应为放热反应,升高温度,其平衡常数减小
B.上述反应中每生成1molSi3N4,转移12mol电子
C.在氮化硅的合成反应中,N2是氧化剂,SiO2是还原剂
D.若使压强增大,上述平衡向逆反应方向移动
难度: 中等查看答案及解析
-
在容积为2.0 L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述不正确的是
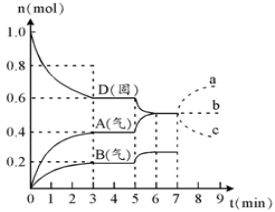
A.从反应开始到第一次达到平衡时,A物质的平均反应速率为0.667mol/(L·min)
B.该反应的化学方程式为2D(s)
2A(g) + B(g)该反应的平衡常数表达式为K=c(A)2·c(B)
C.已知反应的△H>0,则第5分钟时图像呈现上述变化的原因可能是升高体系的温度
D.若在第7分钟时增加D的物质的量,则表示A的物质的量变化正确的是b曲线
难度: 困难查看答案及解析
-
浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随
的变化如图所示,下列叙述错误的是
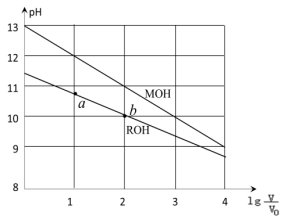
A.MOH的碱性强于ROH的碱性
B.ROH的电离程度:b点大于a点
C.若两溶液无限稀释,则它们的c(OH-)相等
D.当
=2时,若两溶液同时升高温度,则
增大
难度: 困难查看答案及解析
-
某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+m Y(g)
3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
A.m=2 B.两次平衡的平衡常数相同
C.X与Y的平衡转化率之比为1:1 D.第二次平衡时,Z的浓度为0.4 mol·L-1
难度: 中等查看答案及解析
-
已知下列数据
化学键
H—H
Cl—Cl
H—Cl
生成(拆开)1mol化学键放出(吸收)的能量
436kJ
243kJ
431kJ
则下列热化学方程式不正确的是
A.
H2(g)+
Cl2(g)==HCl(g) ;△H=-91.5kJ·mol-1
B.
H2(g)+
Cl2(g)==HCl(g) ;△H=+91.5kJ·mol-1
C.H2(g)+ Cl2(g)==2HCl(g) ;△H=-183kJ·mol-1
D.2HCl(g) ==H2(g)+ Cl2(g) ;△H=+183kJ·mol-1
难度: 中等查看答案及解析
-
在一固体体积的密闭容器中,保持一定温度,进行以下反应:H2(g)+Br2(g)
2HBr(g)。已知加入 l mol H2和 2mol Br2时,达到平衡后,生成 a molHBr。在相同条件下,起始时加入H2、Br2、HBr的物质的量分别为x、y、z(均不为零),如果仍保持平衡后各组分的物质的量分数不变,则以下推断不正确的是
A.达平衡时HBr物质的量可能仍为a mol
B.x、y、z应满足的关系是4x+z=2y
C.达平衡时HBr的物质的量为(x+y+z)a/3
D.x、y、z一定满足关系y=2x
难度: 中等查看答案及解析
-
下列图示与对应的叙述相符的是
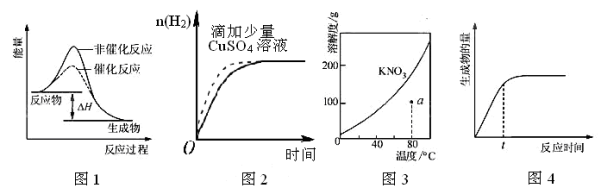
A.图1 表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图2表示常温下,等量锌粉与足量的等浓度的盐酸反应(滴加CuSO4溶液的为虚线)
C.图3表示 KNO3 的溶解度曲线,a点所示的溶液是80℃时KNO3的不饱和溶液
D.图4表示某可逆反应生成物的量随反应时间变化的曲线,t时反应物转化率最大
难度: 中等查看答案及解析
-
已知次氯酸是比碳酸还弱的酸,反应Cl2+H2O
HCl+HClO达到平衡后,要使HClO浓度增大,H浓度减小,可加入
A.Na2SO3固体 B.水 C.CaCO3固体 D.NaOH固体
难度: 中等查看答案及解析
-
黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:
S(s)+2KNO3(s)+3C(s)=K2S(s)+N2(g)+3CO2(g) ΔH=x kJ·mol-1
已知碳的燃烧热ΔH1=a kJ·mol-1
S(s)+2K(s)==K2S(s) ΔH2=b kJ·mol-1
2K(s)+N2(g)+3O2(g)=2KNO3(s) ΔH3=c kJ·mol-1
则x为
A.3a+b-c B.c +3a-b C.a+b-c D.c-a-b
难度: 中等查看答案及解析
-
将2molA和1molB充入某密闭容器中发生反应:2A(g)+B(g)
xC(g),达到化学平衡后,C的体积分数为a。假设该反应的条件分别和下列各选项的条件相同,下列判断正确的是
A.若在恒温恒压下,当x=1时,按1.5molA、1molC作为起始物质,达到平衡后,C的体积分数仍为a
B.若在恒温恒容下,当x=2时,将3molC作起始物质,达到平衡后,C的体积分数仍为a
C.若在恒温恒压下,当x=3时,1molA、1molB、6molC作起始物质,达到平衡后,C的体积分数仍为a
D.若在恒温恒容下,按0.6molA、0.3molB、1.4molC作起始物质,达到平衡后,C的体积分数仍为a,则x为2或3
难度: 困难查看答案及解析
-
室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示。下列说法正确的是

A.稀释前,c(A)=10 c(B)
B.在M点,A、B两种碱溶液中阳离子的物质的量浓度相等
C.稀释前,A溶液中由水电离出的OH-的浓度大于10-7 mol/L
D.由图可知,A为强碱、B为弱碱
难度: 中等查看答案及解析
-
下列叙述中,可以说明金属甲的活动性比金属乙的活动性强的是
A.在氧化-还原反应中,甲原子失去的电子比乙原子失去的电子多
B.同价态的阳离子,甲比乙的氧化性强
C.甲能跟稀盐酸反应放出氢气而乙不能
D.将甲、乙作电极组成原电池时,甲是正极
难度: 中等查看答案及解析
-
某原电池装置如右图,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是

A.正极反应为AgCl +e-=Ag +Cl-
B.放电时,交换膜右侧溶液中有大量白色沉淀生成
C.若用NaCl溶液代替盐酸,则电池总反应随之改变
D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
难度: 中等查看答案及解析
-
下列各组数据关系中,前者比后者大的是
A.100mL 0.01mol/L的CH3COOH溶液与10mL 0.1mol/L的CH3COOH溶液的H+数目
B.常温下pH=4的KHSO4溶液和CH3COOH溶液中由水电离出的OH—离子浓度
C.纯水在100℃时的pH和25℃时的pH
D.100mL 0.01mol/L的CH3COOH溶液与10mL 0.1mol/L的CH3COOH溶液的H+浓度
难度: 中等查看答案及解析
-
如图是用0.1000 mol·L-1 NaOH溶液滴定20.00 mL未知浓度盐酸(酚酞做指示剂)的滴定曲线。下列说法正确的是
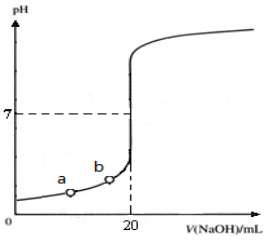
A.水电离出的氢离子浓度:a>b
B.盐酸的物质的量浓度为0.0100 mol·L-1
C.指示剂变色时,说明盐酸与NaOH恰好完全反应,溶液刚好显中性
D.当滴加NaOH溶液10.00 mL时,该混合液的pH=1+lg3
难度: 困难查看答案及解析
-
将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s)
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。下列推断不正确的是

A.该反应的△S>0
B.915 ℃,2.0 MPa时E的转化率为60%
C.b>f
D.K(1000℃)>K(810℃)
难度: 困难查看答案及解析
-
A(g)+B(g)
2C(g)反应在密闭容器中进行,若保持容积不变,在温度分别为T1和T2时,达到平衡,B的体积分数与时间的关系如图所示。现向一体积可变的密闭容器中通入等物质的量的A气体和B气体,在恒温条件下发生反应达到平衡状态Ⅰ后,再升高到某温度,继续反应一段时间后达到平衡状态Ⅱ。下列叙述中正确的是

A.T1>T2,该反应生成物的总能量高于反应物的总能量
B.该反应在高温时才能自发进行
C.由平衡状态Ⅰ到平衡状态Ⅱ的过程中,平衡向逆向移动,A的体积分数一直没有变化
D.反应从开始到平衡状态Ⅱ的过程中,平衡常数K和A的转化率都是先增大后减少
难度: 困难查看答案及解析
-
下列各组离子一定能大量共存的是
A.pH=2的溶液中:SO42-、K+、NO3-、Mg2+
B.pH试纸呈红色的溶液中:Fe2+、K+、NO3-、Na+
C.水电离出的c(H+)=1×10-14mol·L-1的溶液中:Na+、Al3+、Cl-、SO42-
D.CO32-可以大量共存的溶液中:Ag+、K+、NO3-、Cl-
难度: 中等查看答案及解析
-
下列叙述中,正确的是
A.中和10 mL 0.1 mol·L-1 醋酸与中和100 mL 0.01 mol·L-1的醋酸所需同种碱溶液的量不同
B.常温下,pH=3的甲酸溶液的c(H+)与pH=11的氨水溶液中,由水电离产生的c(OH-)相等
C.向NH4Cl溶液中逐渐加入适量NaOH固体,溶液的导电性明显增强
D.向饱和石灰水中加入少量CaO,恢复至室温后溶液中c(OH-)增大,导电能力增强
难度: 中等查看答案及解析
-
某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度下列操作会导致实验结果偏高的是
A.滴加盐酸的过程中,未充分振荡,刚看到溶液变色,立刻停止滴定
B.读取盐酸体积时,滴定前仰视,滴定后俯视
C.盛标准盐酸的滴定管,滴定前无气泡,滴定后出现气泡
D.若滴定前用蒸馏水洗涤锥形瓶和酸式滴定管后,均未经润洗就进行滴定
难度: 中等查看答案及解析