-
下列实验操作中错误的是( )
A.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大难度: 中等查看答案及解析
-
当光束通过下列分散系时,能观察到丁达尔效应的是( )
A.蔗糖溶液
B.盐酸
C.氯化钠溶液
D.Fe(OH)3胶体难度: 中等查看答案及解析
-
科学家发现一种化学式为H3 的氢分子.1mol H3和1mol H2具有相同的( )
A.分子数
B.原子数
C.质子数
D.电子数难度: 中等查看答案及解析
-
能够用来鉴别BaCl2、NaCl、Na2CO3三种物质的试剂是( )
A.AgNO3溶液
B.稀硫酸
C.稀盐酸
D.稀硝酸难度: 中等查看答案及解析
-
下列说法正确的是( )
A.铜、石墨均能导电,所以它们均是电解质
B.NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质
C.液态HCl、固体NaCl均不能导电,所以HCl、NaCl均是非电解质
D.蔗糖、酒精在水溶液或熔融状态下均不能导电,所以它们均是非电解质难度: 中等查看答案及解析
-
下列有关0.2mol•L-1 BaCl2溶液的说法不正确的是( )
A.500mL溶液中Cl-离子浓度为0.2mol•L-1
B.500mL溶液中Ba2+离子浓度为0.2mol•L-1
C.500mL溶液中Cl-离子总数为0.2NA
D.500mL溶液中Ba2+和Cl-离子总数为0.3NA难度: 中等查看答案及解析
-
下列电离方程式,书写正确的是( )
A.Al2(SO4)3=2Al3++3SO42-
B.AlCl3=Al3++Cl3-
C.Mg(NO3)2=Mg+2+2NO3-
D.KMnO4=K++Mn7++4O2-难度: 中等查看答案及解析
-
下列离子检验的方法正确的是( )
A.某溶液加入硝酸银溶液有白色沉淀,说明原溶液中有Cl-
B.某溶液加入氯化钡溶液有白色沉淀,说明原溶液中有SO42-
C.某溶液加入氢氧化钠溶液有蓝色沉淀,说明原溶液中有Cu2+
D.某溶液加入稀硫酸生成无色气体,说明原溶液中有CO32-难度: 中等查看答案及解析
-
溶液、胶体和浊液这三种分散系的本质区别是( )
A.是否有丁达尔现象
B.是否能通过滤纸
C.分散质粒子的大小
D.是否均一、透明、稳定难度: 中等查看答案及解析
-
实验室中需要配制2mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取的NaCl质量分别是( )
A.950 mL,111.2 g
B.500 mL,117 g
C.1 000 mL,117 g
D.任意规格,111.2 g难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数,下列说法中,正确的是( )
A.2.4g金属镁所含电子数目为0.2NA
B.1molH2SO4溶解在水中,溶液所含粒子数目为NA
C.17gNH3所含中子数目为10NA
D.18g水所含分子数目为NA难度: 中等查看答案及解析
-
下列物质中,属于电解质的是( )
A.盐酸
B.NaCl溶液
C.Na2SO4
D.Cu难度: 中等查看答案及解析
-
下列名词中,不属于物理量的是( )
A.物质的量
B.质量
C.摩尔
D.长度难度: 中等查看答案及解析
-
我国的“嫦娥”探月工程已正式启动.据科学家预测,月球的土壤中吸附着数百万吨的
He,全世界如果用“氦3”聚变发电,能用一万到五万年.在地球上,氦元素主要以
He的形式存在.下列说法正确的是( )
A.He原子核内含有4个质子
B.He与
He互为同位素
C.He原子核内含有3个中子
D.He的最外层电子数为2,所以
He具有较强的金属性
难度: 中等查看答案及解析
-
Rn+离子有m个电子,它的质量数为A,则原子核内的中子数为( )
A.m+n
B.A-m+n
C.A-m-n
D.A+m-n难度: 中等查看答案及解析
-
下列物质种类中,前者包含后者的是( )
A.混合物 溶液
B.电解质 化合物
C.浊液 胶体
D.单质 化合物难度: 中等查看答案及解析
-
下列仪器常用于物质分离的是( )
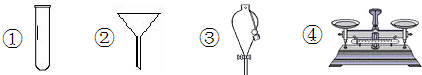
A.②③
B.①④
C.②④
D.①②难度: 中等查看答案及解析
-
将下列各组物质按酸、碱、盐分类顺序排列,正确的是( )
A.硫酸、纯碱、石膏
B.硫酸、烧碱、绿矾
C.硫酸氢钠、生石灰、醋酸钠
D.硝酸、熟石灰、苛性钠难度: 中等查看答案及解析
-
下列实验操作中,所用仪器合理的是( )
A.在蒸发皿中放入NaCl溶液,加热蒸干制取NaCl晶体
B.用100mL的量筒量取5.2mL的盐酸
C.用托盘天平称取25.2gNaCl
D.用100mL容量瓶配制50mL0.1mol/L的盐酸难度: 中等查看答案及解析
-
欲配制100ml 1.0mol/L Na2SO4溶液,正确的方法是( )
①将14.2g Na2SO4溶于100ml水中
②将32.2g Na2SO4•10H2O溶于少量水中,再用水稀释至100ml
③将20ml 5.0mol/L Na2SO4溶液用水稀释至100ml.
A.①②
B.②③
C.①③
D.①②③难度: 中等查看答案及解析
-
下列根据实验现象所得出的结论中,一定正确的是( )
A.无色试液使蓝色石蕊试纸变红,结论:溶液显碱性
B.无色溶液焰色反应呈黄色,结论:试液是钠盐溶液
C.无色试液加入Na2CO3溶液产生白色沉淀,结论:试液中含Ca(OH)2
D.某气体能使湿润的红色石蕊试纸变蓝,结论:该气体为NH3难度: 中等查看答案及解析
-
等体积的硫酸铝、硫酸锌、硫酸钠溶液分别与足量氯化钡溶液反应.若生成硫酸钡沉淀的质量比为1:2:3,则三种硫酸盐的物质的量浓度之比为( )
A.1:2:3
B.1:6:9
C.1:3:3
D.1:3:6难度: 中等查看答案及解析