-
设NA为阿伏加德罗常数的数值。下列有关叙述正确的是
A.标准状况下,22.4LH2S与22.4LH2O中所含的分子数均为NA
B.由6.2gNa2O与7.8gNa2O2组成的混合物中阴离子总数为0.2NA
C.10g49%的硫酸与10g49%的H3PO4溶液中所含的氧原子数均为0.2NA
D.0.1molFe分别与足量的盐酸和氯气反应,转移的电子数均为0.2NA
难度: 困难查看答案及解析
-
合理的实验设计是顺利完成化学实验的有力保障。下列有关化学实验的设计合理的是
A. 在空气中用瓷坩埚煅烧钠制取过氧化钠
B. 采用蒸馏的方法分离碘的四氯化碳溶液
C. 氯气通入溴化铁溶液,比较氯和溴的活泼性
D. H2S气体通入CuSO4溶液,比较氢硫酸和硫酸的酸性
难度: 困难查看答案及解析
-
a、b、c、d、e分别为MgCl2、KHSO4、KOH、NaHCO3、AlCl3五种溶液中的一种,其中a能与其余四种溶液反应,且与c、e反应时有明显的现象;b与d反应只产生气泡;e只能与a反应。下列推理不正确的是( )
A.a一定为KOH B.b一定为KHSO4
C.c一定为AlCl3 D.e一定为MgCl2
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式的是( )
A.Fe3O4溶于足量稀HNO3中:Fe3O4+8H+= Fe2++2Fe3++4H2O
B.NH4HCO3溶液与足量NaOH溶液混合:HCO3-+Na++ OH-=CO32-+ H2O
C.将过量的SO2通入NaClO溶液中:SO2+ClO-+ H2O= HClO+HSO3-
D.将0.2mol•L-1KAl(SO4)2溶液与0.3 mol•L-1Ba(OH)2溶液等体积混合:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3 ↓+ 3BaSO4↓
难度: 困难查看答案及解析
-
“笔、墨、纸、砚”在中国传统文化中被称为“文房四宝”,下列说法中不正确的是
A
B
C
D




用灼烧法可鉴别毛笔羊毫的真伪
用墨写字画画可长久不褪色
纸及造纸原料的主要成分均是纤维素
用石材制作砚台的过程是化学变化
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,现取三份100mL溶液进行如下实验: ①第一份加足量AgNO3溶液后,有白色沉淀产生。②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99 g。③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图。根据上述实验,以下推测不正确的是 ( )
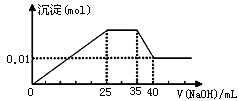
A.原溶液一定不存在H+、Cu2+、CO32-
B.不能确定原溶液是否含有K+、NO3—
C.实验所加的NaOH的浓度为2mol·L-1
D.原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+):n(Al3+):n( NH4+)=1:1:2
难度: 困难查看答案及解析
-
已知:将Cl2通人适量KOH溶液,产物中可能有KC1、KClO、KC1O3,且
的值与温度高低有关.当n(KOH)=amol时,下列有关说法错误的是
A. 若某温度下,反应后
=11,则溶液中
B. 参加反应的氯气的物质的量等于0.5amol
C. 改变温度,反应中转移电子的物质的量ne的范围:
amol≤ne≤
amol
D. 改变温度,产物中KC1O3的最大理论产量为
amol
难度: 困难查看答案及解析
-
短周期元素X、Y、Z、W、M的原子序数依次增大,且原子最外层电子数之和为18,X与Y是组成化合物种类最多的元素,W是地壳中含量最高的元素。下列说法正确的是
A. 原子半径大小顺序:r(Y)>r(Z )>r(W)>r(M)
B. Z的气态氢化物比W的气态氢化物更稳定
C. 分子式为Y5X12的物质只有3种
D. 由三种元素X、Z、W形成的化合物中只有共价键而无离子键
难度: 中等查看答案及解析
-
化学在生活中有着广泛的应用,下列对应关系错误的是
选项
化学性质
实际应用
A
ClO2具有强氧化性
自来水消毒杀菌
B
SO2具有还原性
用作漂白剂
C
NaHCO3受热易分解并且生成气体
焙制糕点
D
Al(OH)3分解吸收大量热量并有H2O生成
阻燃剂
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
①通过化学变化可以实现16O与18O间的相互转化
②煤的汽化和液化属于物理变化
③潮解、焰色反应、汽油去油污、用CS2清洗管壁上的硫均属于物理变化
④只由一种元素组成的物质一定为纯净物
⑤酸分子中含有几个H,则称为几元酸
⑥H2和D2是同素异形体
⑦白磷应保存在水中;
A. ③⑤⑥ B. ①②⑤ C. ③⑦ D. ①④⑥
难度: 中等查看答案及解析
-
某同学进行有关铜、硝酸、硫酸化学性质的实验,实验过程如图所示:
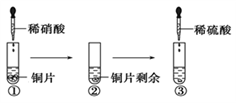
下列说法正确的是
A. ①中溶液呈蓝色,试管口有红棕色气体产生,稀硝酸被还原为NO2
B. ②中溶液存在:c(Cu2+) + c(H+) = c(NO3-) + c(OH-)
C. 由上述实验得出结论:常温下,Cu既可与稀硝酸反应,也可与稀硫酸反应
D. ③中反应的化学方程式:3Cu+Cu(NO3)2+4H2SO4 === 4CuSO4 +2NO↑+4H2O
难度: 中等查看答案及解析
-
下列物质的转化在给定条件下能实现的是
①Al2O3
 NaAlO2(aq)
NaAlO2(aq)Al(OH)3
②S
SO3
H2SO4
③饱和NaCl(aq)
NaHCO3
Na2CO3
④Fe2O3
FeCl3(aq)
无水FeCl3
⑤MgCl2(aq)
Mg(OH)2
MgO.
A. ①③⑤ B. ②③④ C. ②④⑤ D. ①④⑤
难度: 困难查看答案及解析
-
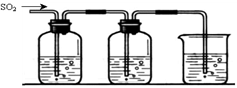
利用下图所示装置进行下列实验,其中丙中实验现象描述正确的是( )
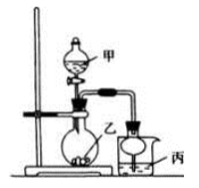
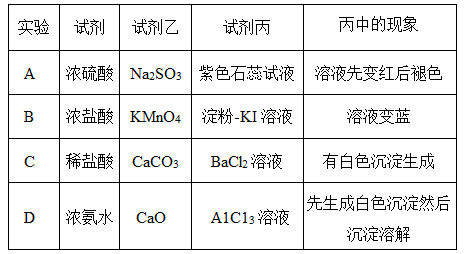
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
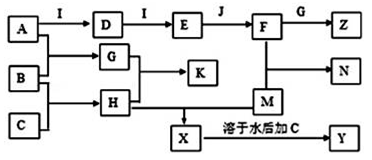
已知W、X、Y、Z均为中学化学里常见的化学物质,它们之间有如下图所示的转化关系。其中不符合图中转化关系的W、X依次是 ( )
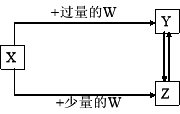
A.W为O2,X为C
B.W为稀HCl,X为NaAlO2溶液
C.W为SO2,X为NaOH溶液
D.W为Cl2,X为Fe
难度: 中等查看答案及解析
-
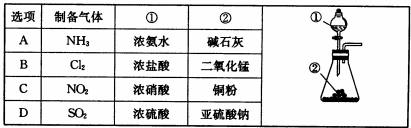
利用表中药品及图示装置不能制取的气体是
难度: 中等查看答案及解析
-
某混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种气体.现将此无色透明的混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色.对于原混合气体成分的判断中正确的是( )
A. 肯定有SO2和NO
B. 肯定没有Cl2和NO2,一定有O2
C. 可能有Cl2和O2
D. 肯定只有NO
难度: 困难查看答案及解析