-
我国明代《本草纲目》中记载了烧酒的制造工艺:“凡酸坏之酒,皆可蒸烧”“以烧酒复烧二次…价值数倍也”。这里用到的实验操作方法是
A. 萃取 B. 蒸馏 C. 分液 D. 过滤
难度: 简单查看答案及解析
-
关于下列各装置的叙述中,正确的是

A. 装置①可用于分离I2与NH4Cl的混合物
B. 装置②用于收集并测量Cu与浓硫酸反应产生的气体的体积
C. 装置③用于制取氯气
D. 装置④用于制取无水MgCl2
难度: 中等查看答案及解析
-
下列各组物质中,任意两种物质在常温下均能发生反应的是
甲
乙
丙
A
SO2
NaOH溶液
新制氯水
B
A1
盐酸
Fe2O3
C
Fe
FeCl2
Cl2
D
NH3
CuO
稀 HNO3
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
向含2 mol NaOH、1 mol Ba(OH)2、2 mol NaAlO2的混合溶液中慢慢通入CO2,则通入CO2的量和生成沉淀的量的关系正确的是
选项
A
B
C
D
n(CO2)(mol)
1
3
5
6
n(沉淀)(mol)
0
2
2
2
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得到的结论正确的是
选项
实验操作
现象
结论
A
将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置
下层溶液显紫红色
氧化性:Fe3+>I2
B
向AgNO3溶液中滴加过量氨水
溶液澄清
Ag+与NH3∙H2O能大量共存
C
将可调高度的铜丝伸入到稀HNO3中
溶液变蓝
Cu与稀HNO3发生置换反应
D
向稀HNO3中加入过量铁粉,再滴入少量KSCN溶液
溶液变红
稀HNO3将Fe氧化为Fe3+
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
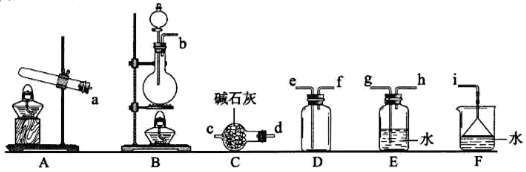
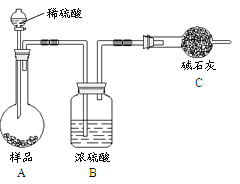
FeCl3易潮解、易升华,实验室制备FeCl3的装置如图所示(加热和夹持装置略去)。下列说法正确的是

A. 导管g的作用是增强装置的气密性
B. 试剂X和试剂Y分别为浓硫酸、饱和食盐水
C. 直接用E接收产物比用导管连接的优点是可防止堵塞
D. F中浓硫酸的作用是防止G中氢氧化钠进入E
难度: 简单查看答案及解析
-
某强酸性溶液中可能存在Al3+、Fe2+、NH4+、Ba2+、Cl-、CO32-、SO42-、NO3-中的若干种,现取适量溶液进行如下实验:
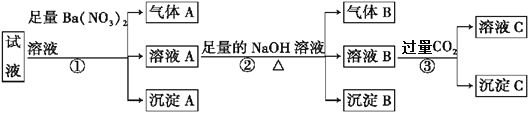
下列有关判断不正确的是
A. 原溶液中一定有Fe2+、SO42-、H+、NH4+、Al3+
B. 原溶液中一定没有Ba2+、CO32-、NO3-
C. 步骤③中反应的离子方程式为2AlO2-+CO2+3H2O2Al(OH)3↓+ CO32-
D. 气体A、B之间能发生反应
难度: 中等查看答案及解析
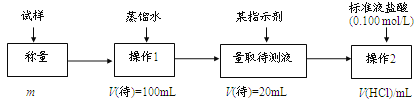
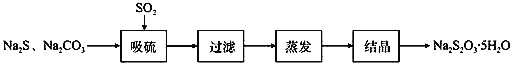
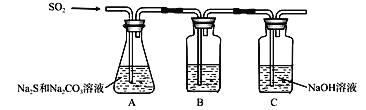


 。
。 的同分异构体中同时符合下列条件的芳香族化合物共有____________种,其中苯环上一氯代物有两种的结构简式为
的同分异构体中同时符合下列条件的芳香族化合物共有____________种,其中苯环上一氯代物有两种的结构简式为