-
化学在生活中应用广泛,下列物质性质与对应用途错误的是
A. 明矾易水解生成胶体,可用作净水剂 B. 晶体硅熔点高硬度大,可用作芯片
C. 氮气化学性质稳定,可用作粮食保护气 D. 溴化银见光易分解,可用作胶片感光剂
难度: 中等查看答案及解析
-
设NA为阿伏加徳罗常数的值。下列有关叙述正确的是
A. .25℃时,1LpH =11的氨水中OH-为0.001 NA
B. 标准状况下,2.24 L SO3的氧原子数为0.3NA
C. 4.6 g乙醇中含有的共价键数为0. 7NA
D. 3.6gD2O所含质子数为2NA
难度: 中等查看答案及解析
-
己知
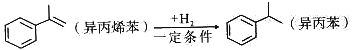 ,下列说法错误的是
,下列说法错误的是A. 该反应属于加成反应 B. 异丙苯的一氯代物共有6种
C. 可用溴水鉴别异丙烯苯和异丙苯 D. 异丙苯是苯的同系物
难度: 中等查看答案及解析
-
某酸性废水可能含有Fe2+、Fe3+、Al3+、Mg2+、Na+、K+、CO32-、SO42-。取废水样品分别进行如右下图所示①~④四个实验。下列推断正确的是
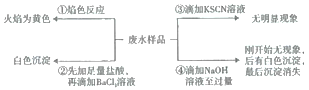
A. 废水含有Na+,不含K+ B. 废水含有SO42-和CO32-
C. 废水不含Fe3+,可能含Fe2+ D. 废水一定含有Na+、Al3+、SO42-
难度: 中等查看答案及解析
-
下列实验操作不能达到实验目的的是
实验目的
实验操作
A
除去蛋白质溶液中混有的(NH4)2SO4
将混合物装入半透膜袋,并放入流动的蒸馏水中
B
除去Mg粉中混有的A1粉
加入足量NaOH溶液,过滤、洗涤、干燥
C
用苯萃取溴水中的Br2
先从分液漏斗下口放出水层,再从上口倒出有机层
D.
测定NaClO溶液的pH
用玻璃棒蘸取溶液点滴在pH上,与标准比色卡对照
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
X、Y、Z、M、Q、R皆为前20号元素,其原子半径与主要化合价的关系如图所示。下列说法错误是
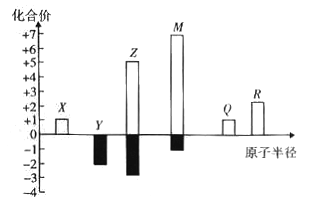
A. Q位于第三周期IA族
B. X、Y、Z三种元素组成的化合物可能是盐或碱
C. 简单离子半径:M->Q+>R2+
D. Z与M的最高价氧化物对应水化物均为强酸
难度: 困难查看答案及解析
-
铁碳微电解技术是利用原电池原理处理酸性污水的一种工艺,装置如图。若上端开口关闭,可得到强还原性的H+(氢原子);若上端开口打开,并鼓入空气,可得到强氧化性的·OH(烃基自由基)。下列说法错误的是
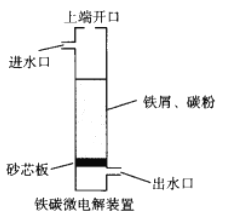
A. 无论是否鼓入空气,负极的电极反应式均为Fe-2e-=Fe2+
B. 不鼓入空气时,正极的电极反应式为H++e-=H·
C. 鼓入空气时,每生成1mol·OH有2mol电子发生转移
D. 处理含有草酸(H2C2O4)的污水时,上端开口应打开并鼓入空气
难度: 中等查看答案及解析
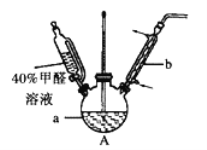
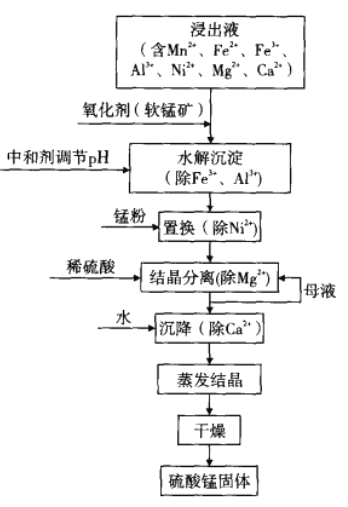
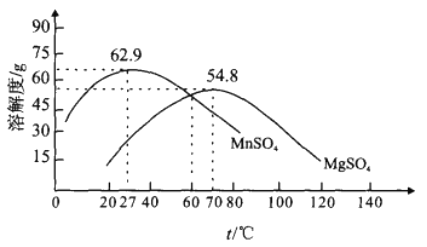
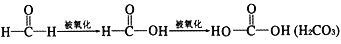 。设计实验证明a中甲醛的碳元素未被氧化成+4 价,___________。
。设计实验证明a中甲醛的碳元素未被氧化成+4 价,___________。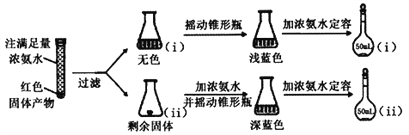
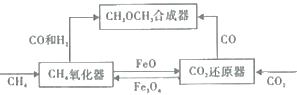
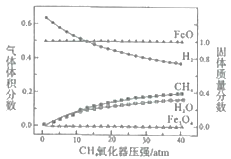
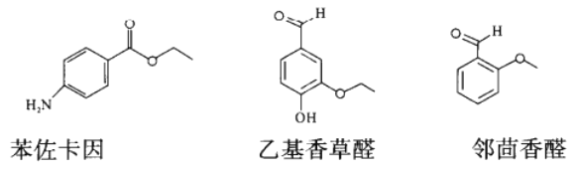

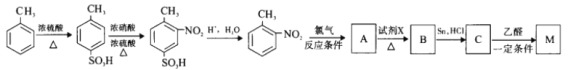
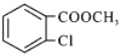 的合成路线___________。
的合成路线___________。