-
有关氧化还原反应的下列叙述正确的是
A.氧化剂发生还原反应,还原剂发生氧化反应
B.氧化剂被氧化,还原剂被还原
C.在氧化还原反应中,氧化剂和还原剂一定是两种不同的物质
D.氧化还原反应中,金属单质只能作还原剂,非金属单质只能作氧化剂
难度: 中等查看答案及解析
-
下列各元素性质的递变规律错误的是( )
A.Li、Be、B原子最外层电子数依次增多
B.P、S、Cl元素的最高正化合价依次升高
C.B、C、N、O、F原子半径依次增大
D.Li、Na、K、Rb的金属性依次增强
难度: 中等查看答案及解析
-
碱性电池具有容量大、放电电流大的特点,因而得到广泛使用,锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应为: Zn(s)+2MnO2(s)+H2O(l)﹦Zn(OH)2(s)+Mn2O3(s)。下列说法错误的是
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e-﹦Mn2O3(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
难度: 中等查看答案及解析
-
A. 容量瓶不能用作长期存放试剂的容器,但是当溶液配制完后,可以用来存放配制的试剂
B. 用500 mL的容量瓶可以直接配制480 mL溶液
C. 容量瓶不可以用来溶解固体,但是可以用来稀释浓的溶液
D. 容量瓶不可以用来加热,但是锥形瓶可以用来加热
难度: 中等查看答案及解析
-
下列关于F、Cl、Br、I性质的比较,不正确的是
A、它们的原子核外电子层数随核电荷数的增多而增多
B、单质的颜色随核电荷数的增多而加深
C、被其它卤素单质从其卤化物中置换出来的可能性随核电荷数的增多而增大
D、它们的氢化物的稳定性随核电荷数的增多而增强
难度: 困难查看答案及解析
-
下列物质中,只含有非极性共价键的是
A、Na2O2 B、NaOH C、O3 D 、H2S
难度: 中等查看答案及解析
-
下列各组的两种溶液中,分别加入足量氨水,观察到的现象相同的是( )
A.FeCl3 、AlCl3 B.NaCl、BaCl2 C.MgCl2、CuCl2 D.FeCl2、FeCl3
难度: 中等查看答案及解析
-
下列递变规律不正确的是
A. Na、Mg、Al还原性依次减弱
B. I2、Br2、Cl2氧化性依次增强
C. C、N、O原子半径依次增大
D. P、S、Cl最高正价依次升高
难度: 简单查看答案及解析
-
下列说法中,错误的是
A、能量变化是化学反应的基本特征之一
B、化学反应中能量变化的大小与反应物的质量多少无关
C、化学反应中必然伴随发生能量变化
D、化学变化中的能量变化主要是由化学键变化引起的
难度: 中等查看答案及解析
-
在周期表中金属和非金属的分界线附近能找到( )
A. 制农药的元素 B. 制催化剂的元素
C. 做半导体的元素 D. 制耐高温合金材料的元素
难度: 简单查看答案及解析
-
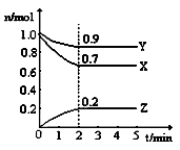
在一定条件下,对于密闭容器中进行的反应:2SO2(g) + O2(g)
2SO3(g),下列说法能充分说明该反应已达到化学平衡状态的是
A. 正、逆反应速率都等于零 B. SO2、O2、SO3的浓度相等
C. SO2、O2、SO3在容器中共存 D. SO2、O2、SO3的浓度均不再变化
难度: 简单查看答案及解析
-
将等物质的量的甲烷和氯气混合后,在漫射光的照射下充分反应,生成物中物质的量最大的是
A、CH3Cl B、CH2Cl2 C、HCl D、CCl4
难度: 中等查看答案及解析
-
能通过化学反应使溴水褪色,又能使酸性高锰酸钾溶液褪色的是
A、甲烷 B、氯化铁 C、乙烷 D、乙烯
难度: 中等查看答案及解析
-
下列物质中只含有共价键的是(____)
A.Na2O2 B.NaCl C.HCl D.Na2O
难度: 简单查看答案及解析
-
下列图示变化为吸热反应的是( )
A.
 B.
B. 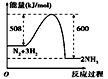
C.
 D.
D. 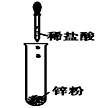
难度: 简单查看答案及解析
-
下表为部分短周期元素的原子半径及主要化合价,根据表中信息判断,下列叙述正确的是
元素代号
X
Y
Z
M
N
原子半径/nm
0.160
0.143
0.102
0.071
0.099
主要化合价
+2
+3
+6、-2
-1
-1
A. X、Y最高价氧化物对应水化物的碱性:Y>X
B. M、N形成的简单离子的还原性:N->M-
C. 气态氢化物的稳定性:HM<H2Z
D. 最高价氧化物对应的水化物的酸性: H2ZO4>HNO4
难度: 中等查看答案及解析
-
下列关于元素周期表和元素周期律的说法不正确的是 ( )
A. 从氟到碘,生成的氢化物熔、沸点逐渐升高,稳定性逐渐减弱
B. 因为钠原子比铝原子容易失去电子,所以钠比铝的还原性强
C. 从钠到氯,最高价氧化物的水化物碱性逐渐减弱,酸性逐渐增强
D. 氧与硫为同主族元素,氧比硫的原子半径小,氧比硫的氧化性强
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. IA族元素的金属性比IIA族元素的金属性强
B. 第三周期元素的离子半径从左到右逐渐减小
C. 同周期非金属氧化物对应的水化物的酸性从左到右依次增强
D. ⅥA族元素的氢化物中,稳定性最好的其沸点也最高
难度: 中等查看答案及解析
-
X、Y、Z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为
和
,Y+和
具有相同的电子层结构。下列说法正确的是
A.原子的最外层电子数:X>Y>Z B.单质沸点:X>Y>Z
C.离子半径:
> Y+>
D.原子序数:X>Y>Z
难度: 困难查看答案及解析
-
已知分解1mol H2O2放出热量98KJ。在含有少量I
的溶液中,H2O2分解的机理为:
① H2O2+ I
H2O+IO
(慢)②H2O2+ IO
H2O+O2+ I
(快)
下列有关该反应的说法正确的是
A. 反应速率与I
浓度有关 B. IO
也是该反应的催化剂
C. 该化学反应速率由反应②决定 D.
难度: 中等查看答案及解析