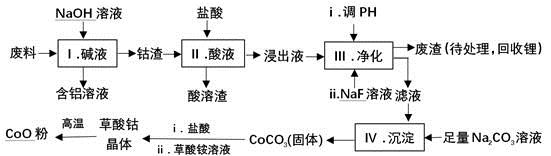
-
下列说法正确的是
A. FeSO4溶液存放在加有少量铁粉的试剂瓶中
B. 将1mol/L的NaCl溶液保存在容量瓶中
C. 凡是给玻璃仪器加热,都要垫石棉网,以防仪器炸裂
D. 用pH试纸检验某溶液的酸碱性时,一定要先用蒸馏水湿润
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A. 氯气溶于水:Cl2+H2O = 2H++Cl-+ClO-
B. NaHCO3的电离方程式:NaHCO3 = Na++ H++CO32-
C. Fe 与盐酸反应:2Fe+6H+=2Fe3++3H2↑
D. Ba(OH)2和 CuSO4溶液反应:Cu2++SO42-+Ba2++2OH-=BaSO4↓+Cu(OH)2↓
难度: 简单查看答案及解析
-
下列实验中,所选装置不合理的是
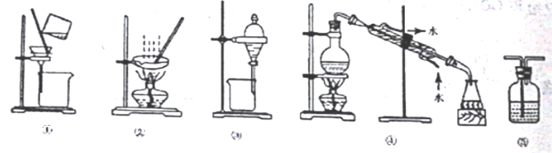
A. 粗盐提纯,选①和②
B. 用CCl4提取碘水中的碘,选③
C. 分离Na2CO3溶液和CH3COOC2H5,选④
D. 用NaOH溶液吸收少量Cl2选⑤
难度: 中等查看答案及解析
-
离子液体在有机合成、无机合成等方面有着重要应用。咪唑是合成“离子液体”的一种原料,其结构如图所示。下列有关咪唑说法不正确的是
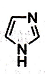
A. 化学式C3H4N2
B. 分子中含有一种非极性键和两种极性键
C. 可以发生取代、加成、氧化反应
D. 一氯取代物的同分异构体共有4种
难度: 中等查看答案及解析
-
下列关于电解质溶液的叙述正确的是
A. 常温下电离常数为Ka的酸HA溶液中c(H+)
mol·L-1
B. 向0.1 mol·L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3·H2O)增大
C. 0.2 mol·L-1CH3COOH溶液与0.1 mol·L-1NaOH溶液等体积混合
2c(H+)-2 c(OH-)=c(CH3COO-)- c(CH3COOH)
D. 将饱和Na2SO4溶液加入到饱和石灰水中,有白色沉淀产生,说明Ksp[Ca(OH)2]大于Ksp(CaSO4)
难度: 中等查看答案及解析
-
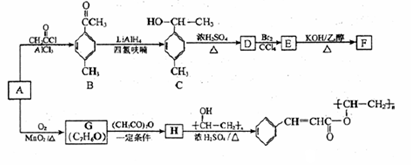
通过膜电池可除去废水中的乙酸钠和对氯笨酚(
),其原理如下图所示,下列说法正确的是
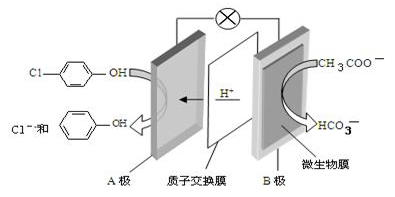
A. B为电池的正极,发生还原反应
B. 电流方向从B极沿导线经小灯泡流向A极
C. A极的电极反应式为:
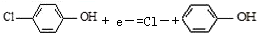
D. 当外电路中有0.2mole-转移时,A极区增加的H+的数目为0.1NA
难度: 困难查看答案及解析
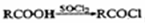 ,参照上述合成路线,以苯和丙酸为原料(无机试剂任选),设计制备
,参照上述合成路线,以苯和丙酸为原料(无机试剂任选),设计制备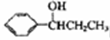 的合成路线________________。
的合成路线________________。