-
2010年4月7日,俄罗斯科学家宣布在实验中获得了117293Un和117294Un两种新原子.下列有关这两种原子的说法错误的是( )
A.质量数均超过质子数的两倍
B.互称为同位素
C.中子数分别为176、177
D.是同一种核素难度: 中等查看答案及解析
-
下列关于有机物的说法正确的是( )
A.棉花、羊毛、蚕丝均属于天然纤维
B.石油的分馏和裂化均属于化学变化
C.油脂不能使溴的四氯化碳溶液褪色
D.甲烷、乙烯、乙炔在一定条件下都能发生加成反应难度: 中等查看答案及解析
-
下列实验方案不合理的是( )
A.用加热法分离碘和氯化铵的混合物
B.用焰色反应鉴别NaCl和KCl
C.用饱和Na2CO3溶液除去乙酸乙酯中混有的乙酸和乙醇
D.用KSCN溶液检验FeCl2是否已被氧化而变质难度: 中等查看答案及解析
-
能把K2SO4、NH4NO3、KCl、(NH4)2SO4、AlCl3五瓶无色溶液加以区别的一种试剂(必要时可以加热)是( )
A.BaCl2
B.Ba(NO3)2
C.Ba(OH)2
D.NaOH难度: 中等查看答案及解析
-
用某种仪器量一液体体积时,平视读数为V1mL,仰视读数为V2mL,俯视读数为V3mL,若V3>V1>V2,则所使用仪器可能是( )
A.容量瓶
B.量筒
C.碱式滴定管
D.以上仪器均不可能难度: 中等查看答案及解析
-
(单选题)X、Y、Z都是第3周期元素,核电荷数依次增大.X的最高价氧化物对应的水化物是强碱,Z的最高价氧化物对应的水化物是强酸.据此判断下列说法不正确的是( )
A.X是第ⅠA元素
B.Z可能是第ⅥA元素或第ⅦA元素
C.X、Y、Z三种元素的最高化合价依次增大
D.X、Z形成的化合物既可以是离子化合物,又可以是共价化合物难度: 中等查看答案及解析
-
下列实验设计合理的是( )
A.除去粗盐中的Ca2+、Mg2+、SO42-,依次加入H2O和Na2CO3、Ba(OH)2、HCl溶液
B.
如图所示装置能用于测量气体的体积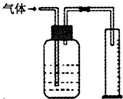
C.用pH试纸可测某新制氯水的pH
D.航海船只的船底四周镶嵌锌块来保护船体难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数,下列说法正确的是( )
A.1moINH2-含有10NA个电子
B.32g甲烷中含有2NA个C-H键
C.5.3Na2CO3溶于水,配成100mL溶液,溶液中CO32-离子的数目为0.05NA
D.1moINa2O2与足量H2O反应,转移电子数为2NA难度: 中等查看答案及解析
-
某温度下,CO2饱和溶液的浓度是0.03mol•L-1,其中1/3的CO2转变为H2CO3,而H2CO3仅有0.1%发生如下电离:H2CO3
H++HCO3-,则溶液的pH约为( )
A.3
B.4
C.5
D.6难度: 中等查看答案及解析
-
下述实验不能达到预期实验目的是( )
A.将2.5gCuSO4•5H2O溶解在97.5g水中 目的是配制质量分数为1.6%的CuSO4溶液
B.向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 目的是说明一种沉淀能转化为另一种更难溶的沉淀
C.室温下,用pH试纸测定浓度为0.1mol•L-1NaClO溶液和0.1mol•L-1CH3COONa溶液的pH 目的是比较HClO和CH3COOH的酸性强弱
D.室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 目的是研究浓度对反应速率的影响难度: 中等查看答案及解析
-
能正确表示下列反应相应的离子方程式是( )
A.将Fe(OH)3溶于HI溶液中:Fe(OH)3+3H+=Fe3++3H2O
B.NaHCO3溶液水【解析】
HCO3-+H2OCO32-+H3O+
C.用硫酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O
D.铁跟盐酸反应2Fe+6H+=2Fe3++3H2↑难度: 中等查看答案及解析
-
现有100mLMgCl2和AlCl3的混合溶液,其中c(Mg2+)=0.2mol•L-1,c(Cl-)=1.3mol•L-1.要使Mg2+完全转化为Mg(OH)2且与Al3+恰好分开,至少需要2mol•L-1的NaOH溶液的体积为( )
A.80mL
B.100mL
C.120mL
D.140mL难度: 中等查看答案及解析
-
室温下某无色透明溶液中由水电离出的H+和OH-浓度的乘积为1×10-24,则此溶液中可能大量共存的离子组为( )
A.HCO3-、Al3+、Na+、SO42-
B.I-、NO3-、K+、NH4+
C.MnO4-、Cl-、SO42-、K+
D.SiO32-、OH-、SO32-、Na+、Cl-难度: 中等查看答案及解析
-
水的电离平衡曲线如图所示,下列说法不正确的是( )
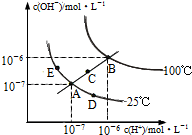
A.图中五点KW间的关系:B>C>A=D=E
B.若从A点到D点,可采用:温度不变在水中加入少量的酸
C.若从A点到C点,可采用:温度不变在水中加入适量的NH4Cl固体
D.若处在B点时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性难度: 中等查看答案及解析
-
高铁酸钾(K2FeO4)是一种既能杀菌、消毒、又能絮凝净水的水处理剂.工业制备高铁酸钾的反应离子方程式为Fe(OH)3+C1O-+OH-→FeO42-+C1-+H2O(未配平).下列有关说法不正确的是( )
A.由上述反应可知,Fe(OH)3的氧化性强于FeO42-
B.高铁酸钾中铁显+6价
C.上述反应中氧化剂和还原剂的物质的量之比为3:2
D.K2FeO4处理水时,不仅能消毒杀菌,而且生成的Fe3+水解形成Fe(OH)3胶体能吸附水中的悬浮杂质难度: 中等查看答案及解析
-
如图装置为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池充、放电的化学方程式为:2K2S2+KI3
K2S4+3KI.装置(Ⅱ)为电解池的示意图.当闭合开关K时,X附近溶液先变红.则下列说法正确的是( )

A.闭合K时,K+从右到左通过离子交换膜
B.闭合K时,A的电极反应式为:3I--2e-=I3-
C.闭合K时,X的电极反应式为:2Cl--2e-=Cl2↑
D.闭合K时,当有0.1molK+通过离子交换膜,X电极上产生标准状况下气体1.12L难度: 中等查看答案及解析
