-
铝合金在日常生活、航空航天和汽车制造等方面均有广泛用途。下列关于铝的说法正确的是
A.铝的表面容易形成致密的氧化膜,抗腐蚀性能好
B.常温下不与任何酸、碱反应
C.铝元素在地壳中的含量高,储量丰富,仅次于铁
D.工业上通常用钠与铝盐溶液反应来制备铝
难度: 中等查看答案及解析
-
将1 mol Na和1 mol Al的混合物投入足量水中,产生气体在标准状况下的体积为( )
A.11.2 L B.22.4 L C.33.6 L D.44.8 L
难度: 中等查看答案及解析
-
镁、铝都是较活泼的金属,下列描述正确的是 ( )
A.镁和铝的单质都能在空气中剧烈燃烧,并放出耀眼的光芒
B.镁和铝能和稀盐酸、强碱反应生成氢气
C.用镁、铝制造的合金质轻坚固,但是不耐腐蚀
D.铝热反应可以放出大量的热,可以使生成的金属熔化
难度: 中等查看答案及解析
-
某溶液中加入铝粉有氢气产生,该溶液中肯定可以大量共存的离子组是 ( )
A.Na+、
、Cl-、
B.Na+、K+、Ba2+、
C.Fe3+、H+、
、Cl- D.Na+、K+、Cl-、
难度: 中等查看答案及解析
-
除去镁粉中的少量铝粉,可选用 ( )
A.硫酸 B.氨水
C.盐酸 D.氢氧化钠溶液
难度: 中等查看答案及解析
-
在500 mL NaOH溶液中加入足量铝粉,反应完全后共收集到标准状况下的气体33.6 L,该NaOH溶液的浓度为 ( )
A.1 mol·L-1 B.2 mol·L-1
C.1.5 mol·L-1 D.3 mol·L-1
难度: 中等查看答案及解析
-
现有一含少量铁、硅的铝合金,取等质量的两份样品,分别投入足量的盐酸和稀氢氧化钠溶液中,放出等量的氢气,则该合金中铁与硅的关系正确的是(已知:Si+2NaOH+H2O====Na2SiO3+2H2↑) ( )
①物质的量之比为2∶1 ②物质的量之比为3∶1
③质量之比为2∶1 ④质量之比为4∶1
A.②④ B.②③ C.①④ D.只有④
难度: 中等查看答案及解析
-
将5.1 g镁和铝投入500 mL 2 mol·L-1的盐酸中,生成氢气0.5 g,金属完全溶解,再加入4 mol·L-1的NaOH溶液,若要使生成的沉淀最多,则应加入NaOH溶液的体积是 ( )
A.200 mL B.250 mL
C.425 mL D.560 mL
难度: 中等查看答案及解析
-
下列关于铝元素的叙述正确的是 ( )
A.铝是一种比较活泼的金属
B.常温下铝不能与氧气反应
C.氧化铝不能通过分解反应制得
D.在化学反应中,铝容易得到电子,是氧化剂
难度: 中等查看答案及解析
-
用坩埚钳夹住一小块刚用盐酸处理过的铝箔,在酒精灯上加热至熔化,发现熔化的铝箔不滴落。下列关于上述实验中有关问题的解释不正确的是 ( )
A.铝在空气中能很快形成氧化膜
B.铝箔失去金属光泽,氧化铝包裹着金属铝
C.氧化铝的熔点比铝高
D.氧化铝与盐酸不反应
难度: 中等查看答案及解析
-
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体体积(V)与时间(t)关系如图。反应中镁和铝(注:反应速率为单位时间内生成气体的量)( )
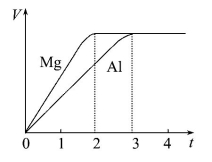
A.物质的量之比为3∶2 B.质量之比为3∶2
C.摩尔质量之比为2∶3 D.反应速率之比为2∶3
难度: 中等查看答案及解析
-
某无色溶液加入铝可以生成H2,则在该溶液中一定能大量存在的离子组是
A.K+、Cu2+、N
、Cl- B.K+、Na+、Br-、Cl-
C.K+、N
、HC
、Cl- D.Na+、Mg2+、Br-、S
难度: 中等查看答案及解析
-
实验室将9 g铝粉跟一定量的金属氧化物粉末混合形成铝热剂。发生铝热反应之后,所得固体中含金属单质为18 g,则该氧化物粉末可能是 ( )
A.Fe2O3和MnO2 B.MnO2和V2O5
C.Cr2O3和V2O5 D.Fe3O4和FeO
难度: 中等查看答案及解析
-
甲、乙两烧杯中各盛有3 mol·L-1的盐酸和氢氧化钠溶液100 mL,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲∶乙=1∶2,则加入铝粉的质量为 ( )
A.5.4 g B.3.6 g C.2.7 g D.1.8 g
难度: 中等查看答案及解析
 溶液
溶液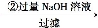 得到沉淀的质量为m2g;
得到沉淀的质量为m2g;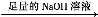 生成的气体在标准状况下的体积为V1L。
生成的气体在标准状况下的体积为V1L。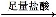 生成的气体在标准状况下的体积为V2L。
生成的气体在标准状况下的体积为V2L。