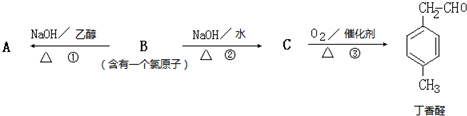
-
25℃时,水中存在电离平衡:H2O⇌H++OH-△H>0.下列叙述正确的是( )
A.将水加热,Kw增大,pH不变
B.向水中加入少量NaHSO4固体,c(H+)增大,Kw不变
C.向水中加入少量NaOH固体,平衡逆向移动,c(OH-)降低
D.向水中加入少量NH4Cl固体,平衡正向移动,c(OH-)增大难度: 中等查看答案及解析
-
关于合金性质的说法中,错误的是( )
A.多数合金的硬度一般比其各成分金属的硬度高
B.多数合金的熔点一般比其各成分金属的熔点低
C.合金的物理性质一般与其各成分金属的物理性质不同
D.合金的化学性质一般与其各成分金属的化学性质不同难度: 中等查看答案及解析
-
为了除去硫酸铜溶液中含有的Fe2+杂质,先加入合适的氧化剂使Fe2+氧化为Fe3+,下列物质中最好选用( )
A.H2O2溶液
B.KMnO4溶液
C.Cl2水
D.HNO3溶液难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.用丁达尔现象可以区分食盐水和硫酸铜溶液
B.用热的纯碱溶液可以更好地去除油污
C.外加直流电源,将钢铁设备作为阴极进行保护
D.锅炉水垢中的硫酸钙可用碳酸钠溶液处理,使之转化为碳酸钙,再用酸除去难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数,下列说法正确的是( )
A.1molOH-中所含电子数为9NA
B.17gNH3所含共用电子对数为3NA
C.常温常压下,11.2LSO2所含的分子数为0.5NA
D.1molH2O完全分解时转移电子数为4NA难度: 中等查看答案及解析
-
同温同压下,等体积的两容器内分别充满14N16O和13C16O气体,下列对两容器中气体判断正确的是( )
A.中子数相同
B.分子数不同
C.质子数相同
D.气体质量相同难度: 中等查看答案及解析
-
常温时,下列各组离子在指定溶液中能大量共存的是( )
A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
B.c(Fe3+)=0.1mol/L的溶液中:K+、ClO-、SO42-、SCN-
C.c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl-
D.由水电离的c(H+)=1×10-14mol/L的溶液中:Ca2+、K+、Cl-、HCO3-难度: 中等查看答案及解析
-
下列离子方程式中正确的是( )
A.硫酸铜水【解析】
Cu2++2H2O═Cu(OH)2↓+2H+
B.氯化亚铁溶液中通入氯气:Fe2++Cl2═Fe3++2C1-
C.向碳酸氢钠溶液中滴加硫酸:H++HCO3-═H2O+CO2↑
D.向碘化钾溶液中加入稀硫酸:4H++4KI+O2═2I2+2H2O+4K+难度: 中等查看答案及解析
-
在一定条件下发生反应 2A(g)═2B(g)+C(g),将2mol A通入2L容积恒定的密闭容器甲中,若维持容器内温度不变,5min末测得A的物质的量为0.8mol.用B的浓度变化来表示该反应的速率为( )
A.0.24mol/
B.0.08mol/
C.0.06mol/
D.0.12mol/难度: 中等查看答案及解析
-
图表示某可逆反应在使用和未使用催化剂时,反应过程和能量的对应关系.下列说法一定正确的是( )
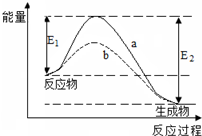
A.该反应为吸热反应
B.a与b相比,a的反应速率更快
C.a与b相比,反应的平衡常数一定不同
D.反应物吸收的总能量小于生成物释放的总能量难度: 中等查看答案及解析
-
常温条件下列溶液中离子浓度的等量关系正确的是( )
A.0.1mol/L氨水中:c(NH4+)+c(H+)=c(OH-)
B.0.1mol/L的NH4Cl溶液中:c(NH4+)=c(Cl-)
C.同为0.1mol/L的硫酸和氨水等体积混合后:c(NH4+)+c=2c(SO42-)
D.pH=3的盐酸和pH=11的氨水等体积混合后:c(OH-)=c(H+)难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.用浓溴水除去苯中的苯酚
B.用核磁共振氢谱鉴别1-丙醇和2-丙醇
C.不慎将苯酚溶液沾到皮肤上,立即用稀NaOH溶液清洗
D.苯与酸性KMnO4溶液混合振荡、静置分层,下层液体为无色难度: 中等查看答案及解析
-
X、Y、Z和W代表原子序数依次增大的4种短周期元素.X元素原子最外层电子数比次外层电子数多1;Z与Y相邻,Z比Y的电子数多8;W元素原子最外层电子数等于电子层数的2倍.下列说法正确的是( )
A.原子半径Y>Z>W
B.Y、Z和W三种元素位于同一周期
C.Y元素最高价氧化物对应的水化物一定是强酸
D.Y、Z的最高正价与最低负价绝对值之和均为8难度: 中等查看答案及解析
-
某温度下,反应 2CH3OH(g)
CH3OCH3(g)+H2O(g)的平衡常数为400.此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
下列说法正确的是( )物质 CH3OH CH3OCH3 H2O 浓度/ 0.44 0.6 0.6
A.CH3OH的起始浓度为1.04mol/L
B.此时逆反应速率大于正反应速率
C.平衡时CH3OH的浓度为0.04mol/L
D.平衡时CH3OH的转化率小于80%难度: 中等查看答案及解析
-
关于物质的检验,下列判断正确的是( )
A.加入AgNO3溶液,生成不溶于稀硝酸的沉淀,则原溶液中一定有Cl-
B.加入盐酸有能使澄清石灰水变浑浊的气体生成,则原溶液中一定有CO32-
C.加入用盐酸酸化的Ba(NO3)2溶液,如果生成白色沉淀,则原溶液中一定有SO42-
D.加入浓NaOH溶液,加热后如果有使湿润的红色石蕊试纸变蓝的气体生成,则原盐溶液中一定有NH4+难度: 中等查看答案及解析
-
用高铁酸钠(Na2FeO4)对饮用水处理是新技术.已知制备高铁酸钠的一种方法是:Fe2O3+3Na2O2
2Na2FeO4+Na2O,下列说法正确的是( )
A.Na2O2是氧化剂
B.该反应属于复分解反应
C.3molNa2O2发生反应,有12mol电子转移
D.在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌难度: 中等查看答案及解析
-
单斜硫和正交硫转化为二氧化硫的能量变化图如右,下列说法正确的是( )
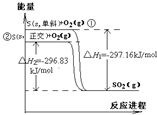
A.相同物质的量的正交硫比单斜硫所含有的能量高
B.正交硫比单斜硫稳定
C.S(s,单斜)=S(s,正交)△H=+0.33kJ/mol
D.①式表示断裂lmolO2中的共价键所吸收的能量比形成1molSO2共价键所放出的能量少297.16kJ难度: 中等查看答案及解析
-
稀土元素在发光材料、储氢材料、激光材料、催化剂、高温超导材料等方面有重要应用.下列关于稀土元素4421Sc(钪)的说法不正确的是( )
A.是一种核素
B.原子核内有23个中子
C.与4721Sc互为同位素
D.比4721Sc少3个电子难度: 中等查看答案及解析
-
下列化学用语表达不正确的是( )
A.乙酸的实验式:CH2O
B.S2-的结构示意图:
C.NH3的结构式:
D.HCl的电子式:难度: 中等查看答案及解析
-
咖啡酸可用作化学原料和中间体,其结构如图.下列关于咖啡酸说法不正确的是( )
A.1mol咖啡酸最多能与3molBr2反应
B.能使高锰酸钾酸性溶液褪色
C.1mol咖啡酸最多能与3molNaOH反应
D.能发生加聚反应难度: 中等查看答案及解析
-
关于图中各装置的叙述不正确的是( )

A.装置①能验证AgCl沉淀可转化为溶解度更小的Ag2S沉淀
B.装置②中X若为四氯化碳,可用于吸收氨气,并防止倒吸
C.装置③的实验可推断硫、碳、硅三种元素的非金属性强弱
D.装置④可检验溴乙烷发生消去反应得到的气体中含有乙烯难度: 中等查看答案及解析