-
对溶液中的离子反应,下列说法:①不可能是氧化还原反应;②只能是复分解反应;③可能是置换反应;④不能有分子参加.其中正确的是( )
A.①③
B.③
C.①②
D.③④难度: 中等查看答案及解析
-
中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700℃时制造出纳米级金刚石粉末.该成果发表在世界权威的《科学》杂志上,立刻被科学家们高度评价为“稻草变黄金”.同学们对此有下列一些理解,其中错误的是( )
A.金刚石属于金属单质
B.制造过程中元素种类没有改变
C.CCl4是一种化合物
D.这个反应是置换反应难度: 中等查看答案及解析
-
下列各组离子,能在溶液中大量共存的是( )
A.H+、Na+、CO32-、Cl-
B.Ba2+、Na+、Cl-、SO42-
C.K+、H+、SO42-、OH-
D.Ag+、Al3+、NO3-、H+难度: 中等查看答案及解析
-
近年来,环境问题越来越引起人们的重视.温室效应、酸雨、臭氧层被破坏、赤潮、沙尘暴等已经给我们赖以生存的环境带来很大的影响.造成酸雨的主要有害物质是( )
A.CO2
B.硫和氮的氧化物
C.含氟化合物(氟利昂)
D.化肥和含磷洗衣粉的使用及其污水的排放难度: 中等查看答案及解析
-
下列情况会对人体健康造成较大危害的是( )
A.自来水中通入少量Cl2进行消毒杀菌
B.用米醋清洗热水瓶胆内壁附着的水垢(含CaCO3)
C.用SO2漂白食品
D.用小苏打发酵面团,制作馒头难度: 中等查看答案及解析
-
起固定氮作用的化学反应是( )
A.N2与H2在一定条件下反应生成NH3
B.NO遇O2转化为NO2
C.硝酸工厂用NH3氧化制NO
D.由NH3制碳酸氢铵和硫酸铵难度: 中等查看答案及解析
-
下列说法错误的是( )
A.纯碱不是碱,溶液显碱性
B.水玻璃不是玻璃,可以粘玻璃
C.干冰不是冰,常作致冷剂
D.醋酸不是酸,能被碱中和难度: 中等查看答案及解析
-
下列实验操作正确的是( )
A.实验:除去碳酸氢钠粉末中的碳酸钠粉末;
操作:将固体混合物放入试管内,试管口稍低于试管底,固定于铁架台上,加热至不再有气体放出
B.实验:配制一定物质的量浓度的氯化钾溶液;
操作:准确称取一定质量的氯化钾固体,放入到1000mL的容量瓶中,加水至1000mL溶解,振荡摇匀
C.实验:稀释浓硫酸;
操作:将蒸馏水沿烧杯内壁慢慢注入盛浓硫酸的烧杯中,并用玻璃棒不断搅拌,使产生的热量不断散失
D.实验:取出分液漏斗中的上层液体;
操作:下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体从分液漏斗上口倒出难度: 中等查看答案及解析
-
向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中轻缓地加入一块绿豆大小的金属钠,可能观察到的现象符合下图中的( )
A.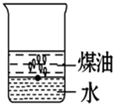
B.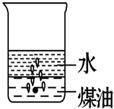
C.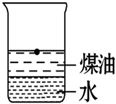
D.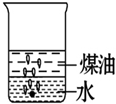
难度: 中等查看答案及解析
-
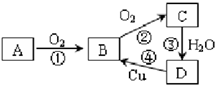
小强在奥运五连环中填入了5种物质,使相连环物质间能发生反应,不相连环物质间不能发生反应.你认为“五连环”中物质间发生的反应,没有涉及的基本反应类型和属于氧化还原反应的个数为( )
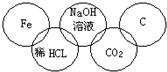
A.化合反应、3个
B.分解反应、2个
C.复分解反应、1个
D.置换反应、2个难度: 中等查看答案及解析
-
制备氯化物时,常用两种方法:①用金属与氯气直接化合制得;②用金属与盐酸反应制得.用以上两种方法都可制得的氯化物是( )
A.AlCl3
B.FeCl3
C.FeCl2
D.CuCl2难度: 中等查看答案及解析
-
NA为阿伏加德罗常数,下列说法正确的是( )
A.1molNa2O2与H2O完全反应,转移2NA个电子
B.2L0.5mol/L的氯化镁溶液中所含的粒子数为3NA
C.NA个SO2分子所占的体积与NA个SO3分子所占的体积比1:1
D.标准状况下,5.6L氯气和16.8L氧气的混合气体中含有分子数为NA难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.稀硝酸跟过量的铁反应:Fe+2H+=Fe2++H2↑
B.稀盐酸与氢氧化钡溶液反应:H++OH-=H2O
C.实验室用MnO2和浓盐酸制Cl2:MnO2+4HCl=2Cl2↑+2H2O+MnCl2
D.稀硫酸与氢氧化钡溶液反应:Ba2++OH-+SO42-+H+=BaSO4↓+H2O难度: 中等查看答案及解析
-
用NaOH固体配制1mol/L的NaOH溶液500ml,下列操作和说法中正确的是( )
A.称量时,将固体NaOH直接放在天平左盘上
B.将烧杯中溶解固体NaOH所得溶液,立即转移至500ml容量瓶中
C.缓缓地将蒸馏水注入500ml容量瓶至溶液的凹液面正好与刻度线相切
D.配制溶液时容量瓶中原来有少量蒸馏水不会影响实验结果难度: 中等查看答案及解析
-
已知气体的摩尔质量越小,扩散速度越快.右图所示为气体扩散速度的试验,两种气体扩散相遇时形成白色烟环.下列关于物质甲、乙的判断正确的是( )
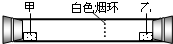
A.甲是浓氨水,乙是浓硫酸
B.甲是浓盐酸,乙是浓氨水
C.甲是浓氨水,乙是浓盐酸
D.甲是浓硝酸,乙是浓氨水难度: 中等查看答案及解析
-
下列有关试剂的保存方法,错误的是( )
A.少量的钠保存在煤油中
B.浓硝酸保存在无色玻璃试剂瓶中
C.氢氧化钠溶液保存在具橡皮塞的玻璃试剂瓶中
D.氢氟酸通常保存在塑料瓶中难度: 中等查看答案及解析
-
用图装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
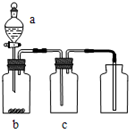
A.气体是NO2;a为浓硝酸;b为铜片;c为NaOH溶液
B.气体是SO2;a为浓硫酸;b为Cu;c为酸性品红溶液
C.气体是NH3;a为浓氨水;b为生石灰;c为浓硫酸
D.气体是CO2;a为稀盐酸;b为CaCO3;c为饱和NaHCO3溶液难度: 中等查看答案及解析
-
根据以下几个反应:
①Cl2+2KI=2KCl+I2
②2FeCl2+Cl2=2FeCl3
③2FeCl3+2KI=2FeCl2+2KCl+I2
④I2+SO2+2H2O=H2SO4+2HI
判断氧化性由强到弱的顺序是( )
A.Cl2>I2>Fe3+>SO2
B.Cl2>Fe3+>I2>SO2
C.Cl2>Fe3+>SO2>I2
D.Fe3+>I2>Cl2>SO2难度: 中等查看答案及解析