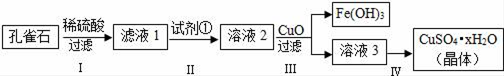
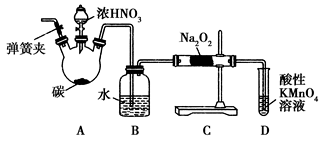
-
化学与生活、社会发展息息相关,下列有关说法或做法不正确的是( )
A. 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈
B. 因患“禽流感”而被捕杀的家禽尸体常用生石灰处理
C. 《本草经集注》中记载了区分硝石(KNO3)和朴消(Na2SO4)的方法:“以火烧之,紫青烟起,乃真硝石也”;这是利用了“焰色反应”
D. 煤经过气化和液化等物理变化可以转化为清洁燃料
难度: 中等查看答案及解析
-
下列物质中,不能由相应的单质化合而成的是
A Na2O2 B
FeCl2 C Fe3O4 D Cu2S
难度: 简单查看答案及解析
-
下列说法中正确的是
A.二氧化硫的排放会造成温室效应
B.绿色食品是不含任何化学物质的食品
C.利用丁达尔效应可区分溶液与胶体
D.用加热的方法不能鉴别NaHCO3和Na2CO3
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法错误的是
A. 5NH4NO3
2HNO3+4N2↑+9H2O的反应中,生成28 g N2,转移的电子数目为3.75NA
B. 常温常压下,7.8 gNa2S和Na2O2的混合物中,阴离子所含电子数为1.8NA
C. 50ml 12 mol•L﹣1盐酸与足量MnO2共热,转移的电子数为小于0.3NA
D. 标况下11.2LNO和11.2LO2混合后所得气体分子数为NA
难度: 中等查看答案及解析
-
水热法制备纳米颗粒Y(化合物)的反应为:3Fe2++2S2O32-+O2+aOH-=Y+S4O62-+2H2O。下列说法中,不正确的是 ( )。
A. S2O32-是还原剂
B. Y的化学式为Fe2O3
C. a=4
D. 每有1 mol O2参加反应,转移的电子总数为4 mol
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是( )
A. 氧化铜溶于浓硝酸:CuO+2H+=Cu2++H2O
B. 往碳酸镁中滴加稀盐酸:CO32-+2H+=CO2↑+H2O
C. NaAlO2溶液中通入过量CO2:2AlO2—+CO2+3H2O=2Al(OH)3↓+CO32-
D. 向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O
难度: 中等查看答案及解析
-
下列关于离子检验的说法正确的是 ( )
A. 检验用硫酸亚铁制得的硫酸铁中是否含有硫酸亚铁,可选用的试剂是酸性KMnO4溶液
B. 检验溶液中是否含有Ba2+:取少量待测液,向其中加入少量稀硫酸,若有白色沉淀产生,则溶液中含有Ba2+
C. 检验溶液中是否含有CO32-:取少量待测液,向其中加入适量稀盐酸,观察是否有大量气泡产生
D. 在未知溶液中滴加BaCl2溶液出现白色沉淀,加稀硝酸,沉淀不溶解,说明该未知溶液中存在SO42-或SO32-
难度: 中等查看答案及解析
-
将0.8g NaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是


A B


C D
难度: 中等查看答案及解析
-
标准状况下,VL氨气溶解在1L水中(水的密度近似为1g/ml),所得溶液的密度为ρg/ml,质量分数为ω,物质浓度为c mol/L,则下列关系中不正确的是
A.ρ=
B.ω=
C.ω=
D.C=
难度: 困难查看答案及解析
-
有NaCl、FeCl2 、FeCl3 、MgCl2 、CuCl2、AlCl3 、NH4Cl六种溶液, 只用一种试剂就可以把它们鉴别开来,该试剂是( )
A. 稀H2SO4 B. 氨水 C. NaOH溶液 D. 稀HNO3
难度: 中等查看答案及解析
-
Na2FeO4是一种高效多功能水处理剂,应用前景十分看好。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2 ===2Na2FeO4 +2Na2O+2Na2SO4 +O2↑,对此反应下列说法中正确的是( )
A. Na2FeO4既是还原产物又是氧化产物
B. 2 mol FeSO4发生反应时,反应中共有8 mol电子转移
C. 每生成16 g氧气就有1 mol Fe2+ 被还原
D. Na2O2只作氧化剂
难度: 中等查看答案及解析
-
同温、同压下等质量的SO2气体和CO2气体,下列有关比较的叙述中,正确的是( )
①密度比为16∶11 ②密度比为11∶16 ③体积比为16∶11 ④体积比为11∶16
A.①③ B.①④ C.②③ D.②④
难度: 困难查看答案及解析
-
取浓度相等的NaOH和HCl溶液,以3:2体积比相混合(忽略溶液体积变化),所得溶液中的c(OH﹣)=0.01mol/L,则原溶液的浓度为( )
A. 0.01 mol/L B. 0.017 mol/L C. 0.05 mol/L D. 0.50 mol/L
难度: 中等查看答案及解析
-
已知
NH4CuSO3与足量的1mol·L-1硫酸溶液混合微热,产生下列现象:①有红色金属生成;②有刺激性气味气体产生;③溶液呈蓝色。据此判断下列说法合理的是( )
A.NH4CuSO3中硫元素被氧化了
B.该反应中NH4CuSO3既是氧化剂又是还原剂
C.刺激性气味的气体是二氧化硫或氨气
D.该反应中硫酸既表现为酸性又表现氧化性
难度: 困难查看答案及解析