-
19世纪中叶,俄国化学家门捷列夫的突出贡献是 ( )
A. 提出原子学说 B. 发现元素周期律 C. 提出分子学说 D. 发现氧气
难度: 简单查看答案及解析
-
在元素周期表中,第3、4、5、6周期所含元素的数目分别是 ( )
A. 8、18、32、32 B. 8、18、18、32
C. 8、18、18、18 D. 8、8、18、18
难度: 简单查看答案及解析
-
根据原子序数推断,下列各组元素化合时能以离子键结合的是 ( )
A. 10与19 B. 6与16 C. 11与17 D. 14与8
难度: 简单查看答案及解析
-
下列微粒中,与氩原子具有相同电子层结构的是 ( )
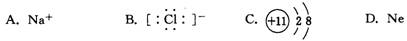
难度: 简单查看答案及解析
-
某元素最高价氧化物对应水化物的分子式是H4RO4,则其氢化物的分子式( )
A. RH4 B. RH3 C. H2R D. HR
难度: 简单查看答案及解析
-
某微粒用 AZQn+表示,下列关于该微粒的叙述正确的是( )
A. 所含质子数= A-n B. 所含中子数=A-Z
C. 所含电子数=Z+n D. 质量数=Z+A
难度: 简单查看答案及解析
-
168O、188O、O2-、O2、O3是:( )
A.氧元素的五种不同微粒 B. 五种氧元素
C. 氧的五种同素异形体 D. 氧的五种同位素
难度: 简单查看答案及解析
-
下列过程中,共价键被破坏的是( )
A. 溴挥发 B. 氯气被木炭吸附 C. 食盐溶于水 D. 硫酸溶于水
难度: 简单查看答案及解析
-
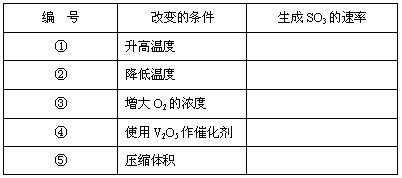
下列说法中正确的是( )
A. 光是影响某些化学反应速率的外界条件之一
B. 决定化学反应速率的主要因素是反应物自身的状态
C. 对于任何反应来说,升高温度、增大压强、使用催化剂都能加快化学反应速率
D. 对于任何反应来说,使用催化剂都能加快化学反应的速率,缩短反应达平衡所需的时间
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.化学反应中的能量变化,都表现为热量的变化
B.需要加热才能发生的反应,一定是吸收能量的反应
C.释放能量的反应在常温下一定很容易发生
D.是吸收能量的反应还是释放能量的反应,可以看破坏化学键所需能量和形成化学键所释放能量的相对大小
难度: 简单查看答案及解析
-
1 mol H—H键的键能是436kJ,1 mol I—I键的键能是151kJ,1 mol H—I键的键能是299kJ,则对反应H2(g)+I2(g)
2HI(g)的说法,不正确的是 ( )
A.吸热反应 B.放热反应 C.化合反应 D.可逆反应
难度: 简单查看答案及解析
-
下列哪种说法可以证明反应:N2+3H2
2NH3已达到平衡状态( )
A. 1个N≡N键断裂的同时,有3个H—H键形成
B. 1个N≡N键断裂的同时,有3个H—H键断裂
C. 1个N≡N键断裂的同时,有6个N—H键形成
D. 3个H—H键断裂同时,有6个N—H键形成
难度: 简单查看答案及解析
-
可逆反应: 2A(气) + 3B(气)
3C(气), 在一定的条件下, 使一定量A和B气体反应, 达到平衡状态时, 具有的性质是( )
A.各物质的浓度之比为 [A] : [B] : [C] = 2 : 3 : 3
B.平衡时气体的总体积是反应开始时的 3/5
C.平衡混合物中各组份的浓度相等
D.单位时间内, 若消耗了 a mol A 物质, 同时也消耗了 1.5 a mol 的C物质
难度: 简单查看答案及解析
-
下列关于物质性质变化的比较中正确的是 ( )
①酸性:HClO4>HBrO4>HIO4 ②碱性:Ba(OH)2>Ca(OH)2>Mg(OH)2
③热稳定性:HCl>H2S>PH3 ④还原性:F—>Cl—>Br—
A.①②④ B.②③④ C.①②③ D.①②③④
难度: 简单查看答案及解析
-
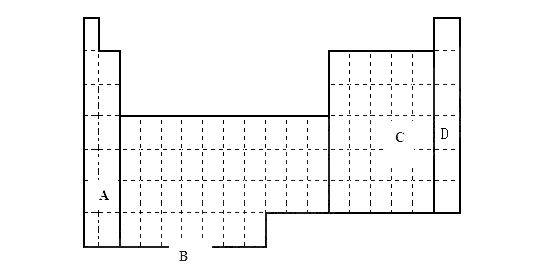
短周期元素X、Y、Z在周期表中的位置关系如图所示,已知X最外层电子数为2,则下列叙述中正确的是 ( )
A.Z一定是活泼的金属元素
B.Y的最高价氧化物的水化物是一种强酸
C.1molX的单质跟足量水反应时,发生转移的电子为2mol
D.Y的氢化物稳定性大于Z的氢化物稳定性
难度: 简单查看答案及解析
-
在密闭容器里,A与B反应生成C,其反应速率分别用
、
、
表示,已知2
=3
、3
=2
,则此反应可表示为( )
A.2A+3B=2C B.A+3B=2C C.3A+B=2C D.A+B=C
难度: 简单查看答案及解析
-
等温、等压、等质量的气体:H2、D2、T2,下列叙述中正确的是( )
①密度之比为l︰2︰3 ②质子数之比为6︰3︰2
③中子数之比为0︰3︰4 ④体积之比为6︰3︰2
A.①②③④ B.②③④ C.①② D.③④
难度: 简单查看答案及解析
-
若短周期中的两种元素可以形成原子个数比为2:3的化合物,则这两种元素的原子序数之差不可能是( )
A. 1 B.3 C. 5 D. 6
难度: 简单查看答案及解析