-
下列实验操作正确的是 ( )。
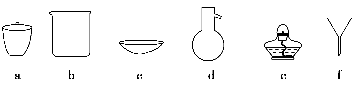
A.用100 mL容量瓶配制50 mL 0.1 mol·L-1 H2SO4溶液
B.中和热测定的实验中使用的玻璃仪器只有2种
C.分液漏斗、滴定管、容量瓶在使用前均需检查是否漏水
D.漂白粉能露置在空气中保存
难度: 中等查看答案及解析
-
按以下实验方案可以从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物。
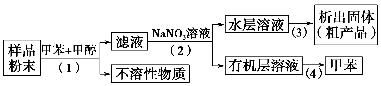
下列说法错误的是 ( )。
A.步骤(1)需要过滤装置
B.步骤(2)需要用到分液漏斗
C.步骤(3)需要用到坩埚
D.步骤(4)需要蒸馏装置
难度: 中等查看答案及解析
-
为提纯下列物质(括号内的物质是杂质)所选用的除杂试剂和分离方法都正确的是 ( )。
被提纯的物质 除杂试剂 分离方法
A 溴化钠溶液(NaI) 新制氯水、CCl4 萃取、分液
B 氯化铵溶液(FeCl3) 氢氧化钠溶液 过滤
C 二氧化碳(CO) 氧化铜粉末 通过灼热的氧化铜粉末
D 碳酸钠(偏铝酸钠) 盐酸 过滤
难度: 中等查看答案及解析
-
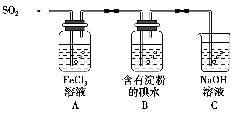
下列实验装置正确的是 ( )。

A.用图甲所示装置收集SO2气体
B.用图乙所示装置检验溴乙烷与NaOH醇溶液共热产生的乙烯
C.用图丙所示装置从食盐水中提取NaCl
D.用图丁所示装置制取并收集O2
难度: 中等查看答案及解析
-
下列实验设计能完成或实验结论合理的是 ( )。
A.证明一瓶红棕色气体是溴蒸气还是二氧化氮,可用湿润的碘化钾淀粉试纸检验,观察试纸颜色的变化
B.铝热剂溶于足量稀盐酸再滴加KSCN溶液,未出现血红色,该铝热剂不含氧化铁
C.测氯水的pH可用玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较
D.用新制氢氧化铜悬浊液可以鉴别甲酸、甲酸甲酯、乙酸、乙酸乙酯四种物质
难度: 中等查看答案及解析
-
下列有关实验装置的说法中正确的是 ( )。

A.用图1装置制取干燥纯净的NH3
B.用图2装置制备Fe(OH)2并能较长时间观察其颜色
C.用图3装置可以完成“喷泉”实验
D.用图4装置测量Cu与稀硝酸反应产生气体的体积
难度: 中等查看答案及解析
-
现有一瓶标签上注明为葡萄糖酸盐(钠、镁、钙、铁)的复合制剂,某同学为了确认其成分,取部分制剂作为试液,设计并完成了如下实验:
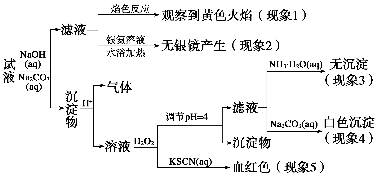
已知:控制溶液pH=4时,Fe(OH)3沉淀完全,Ca2+、Mg2+不沉淀。该同学得出的结论正确的是 ( )。
A.根据现象1可推出该试液中含有Na+
B.根据现象2可推出该试液中并不含有葡萄糖酸根
C.根据现象3和4可推出该试液中含有Ca2+,但没有Mg2+
D.根据现象5可推出该试液中一定含有Fe2+
难度: 中等查看答案及解析
-
下列有关实验操作、实验现象和结论都正确的是 ( )。
选项 实验操作 实验现象 结论
A 在Ba(NO3)2溶液中分别滴入H2SO3和H2SO4溶液 均有白色沉淀 沉淀均为BaSO4
B 混合装有Cl2和NH3两集气瓶中的气体 产生大量白烟 NH3显还原性和碱性
C 溶液X中滴入盐酸酸化的FeCl3溶液,再滴入淀粉溶液 溶液变蓝色 溶液X中一定含有I-
D 向浓度均为0.01 mol·L-1的NaCl和Na2S的混合溶液中滴入少量AgNO3溶液 出现黑色沉淀 Ksp(Ag2S)> Ksp(AgCl)
难度: 中等查看答案及解析