-
下列与生产、生活相关的说法不正确的是( )
A.CO2和CH4都是温室气体
B.酿酒过程中,淀粉水解不能得到乙醇
C.天然气和液化石油气的主要成分都是甲烷
D.使用一定的催化剂可将汽车尾气中的CO和NO转化成CO2和N2难度: 中等查看答案及解析
-
下列说法正确的是( )
A.Si是一种非金属主族元素,其晶体可用于制作计算机芯片
B.工业上通常用电解Na、Fe、Cu对应的氯化物制得该三种金属单质
C.Cl、Br、I的非金属性逐渐减弱,HCl、HBr、HI水溶液的酸性逐渐减弱
D.S、P、Cl 得电子能力和它们相应的最高价氧化物对应水化物的酸性均依次增强难度: 中等查看答案及解析
-
下列解释事实的化学方程式或离子方程式不正确的是( )
A.用食醋除去暖水瓶中的水垢:2CH3COOH+CaCO3═Ca2++2CH3COO-+CO2↑+H2O
B.自然界各种原生铜的硫化物经氧化、淋滤作用后产生的硫酸铜,遇到难溶的PbS,慢慢转变为铜蓝(CuS):Cu2++SO42-+PbS═CuS+PbSO4
C.在盐碱地(含较多NaCl、Na2CO3)上通过施加适量CaSO4,可降低土壤的碱性:CaSO4+Na2CO3═CaCO3↓+Na2SO4
D.在燃煤时加入适量石灰石,可减少SO2的排放:2CaCO3+O2+2SO2═2CaSO3+2CO2难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.标准状况下,2.24 L NH3中含有6.02×1022个共价键
B.100 mL 1 mol/L 的Na2CO3溶液中含有6.02×1022个CO32-
C.将4 g NaOH溶于100 g蒸馏水,所得溶液物质的量浓度是0.1 mol/L
D.将7.8 g Na2O2放入足量的水中,反应时转移6.02×1022个电子难度: 中等查看答案及解析
-
关于如图装置说法正确的是( )
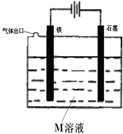
A.装置中电子移动的途径是:负极→Fe→M溶液→石墨→正极
B.若 M为NaCl溶液,通电一段时间后,溶液中可能有NaClO
C.若M为FeCl2溶液,可以实现石墨上镀铁
D.若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀难度: 中等查看答案及解析
-
常温时,在X的溶液中先滴入几滴酚酞溶液后变红,再加入等体积的Y的溶液,混合溶液一定显红色的是(溶液物质的量浓度均为0.01mol/L)
X Y A 氢氧化钡 明矾 B 醋酸钠 醋酸 C 碳酸氢钠 石灰水 D 氢氧化钠 硫酸
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
PCl3和PCl5都是重要的化工原料.将PCl3(g) 和Cl2(g)充入体积不变的2L密闭容器中,在一定条件下发生下述反应,并于10min时达到平衡:PCl3(g)+Cl2(g)⇌PCl5(g),有关数据如下:
下列判断不正确的是( )PCl3(g) Cl2(g) PCl5(g) 初始浓度(mol/L) 2.0 1.0 平衡浓度(mol/L) c1 c2 0.4
A.10 min内,v(Cl2)=0.04 mol/
B.当容器中Cl2为1.2 mol时,反应达到平衡
C.升高温度(T1<T2),反应的平衡常数减小,平衡时PCl3的<1
D.平衡后移走2.0 mol PCl3和1.0 molCl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L难度: 中等查看答案及解析
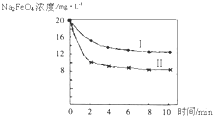
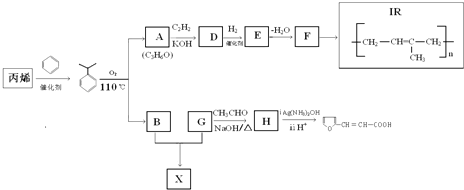
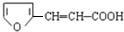 有多种同分异构体,符合下列要求的有________种.
有多种同分异构体,符合下列要求的有________种.