-
已知H2(g)+Br2(l)=2HBr(g);△H=-72kJ/mol.蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
则表中a为( )H2(g) Br2(g) HBr(g) 1mol分子中的化学键断裂时
需要吸收的能量/KJ436 a 369
A.404
B.260
C.230
D.200难度: 中等查看答案及解析
-
在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)⇌zC(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30mol/L.下列有关判断不正确的是( )
A.x+y>z
B.平衡向正反应方向移动
C.B的转化率降低
D.C的体积分数下降难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.Na2S溶液的水【解析】
S2-+2H2O⇌H2S+2OH-
B.NaHCO3溶液的电离:HCO3-+H2O⇌H2 CO3+OH-
C.NH4Cl溶液的水【解析】
NH4++H2O⇌NH3•H2O+H+
D.把金属铁放入稀硫酸中:2Fe+6H+=2Fe3++3H2↑难度: 中等查看答案及解析
-
0.1mol/LNaOH溶液和0.1mol/LNH4Cl溶液等体积混合后,溶液中离子浓度关系正确的是( )
A.c(NH4+)+c(H+)=c(OH-)
B.c(Na+)=c(Cl-)>c(H+)=c(OH-)
C.c(NH4+)+c=2c(Cl-)
D.c(NH4+)>c>c(OH-)>c(H+)难度: 中等查看答案及解析
-
对水的电离平衡不产生影响的粒子是( )
A.Al3+
B.CH3COOH
C.K+
D.HCl难度: 中等查看答案及解析
-
室温下浓度为0.1mol/L的三种一元碱溶液:AOH、BOH、COH,其中AOH中的c(OH-)=0.01mol/L,BOH的电离度为1%,COH的c(H+)=1×10-13mol/L,则室温下三种碱所形成的氯化物:ACl、BCl、CCl的溶液在物质的量浓度相同的情况下,其pH由大到小的顺序是( )
A.ACl>BCl>CCl
B.CCl>ACl>BCl
C.CCl>BCl>ACl
D.BCl>ACl>CCl难度: 中等查看答案及解析
-
下列关于反应热的说法正确的是( )
A.在稀溶液中所有酸和碱反应的中和热数值都相等
B.已知C(s)+½O2(g)=CO(g)△H=-110.5kJ/mol,说明碳的燃烧热为-110.5kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关难度: 中等查看答案及解析
-
关于中和热测定实验的下列说法不正确的是( )

A.烧杯间填满碎泡沫塑料是减少实验过程中的热量损失
B.使用环形玻璃棒既可以搅拌又避免损坏温度计
C.向盛装酸的烧杯中加碱时要小心缓慢
D.测了酸后的温度计要用水清洗后再测碱的温度难度: 中等查看答案及解析
-
中国已经成为全球最大轿车生产国,汽车尾气正成为城市的主要空气污染源.NO和CO都是汽车尾气中的有害物质,它们能缓慢反应生成N2和CO2,为控制汽车污染有人提出以下建议,你认为合理的是( )
A.增大压强
B.使用催化剂
C.降低压强
D.升高反应温度难度: 中等查看答案及解析
-
下列有关化学反应速率的说法正确的是( )
A.凡是能量达到活化能的分子发生的碰撞均为有效碰撞
B.增大反应物浓度能加快正反应的反应速率,降低逆反应的反应速率
C.温度升高使化学反应速率加快的主要原因是增加了反应物分子之间的碰撞次数
D.决定化学反应速率的根本因素是参加反应的各物质的性质难度: 中等查看答案及解析
-
一定温度下,密闭容器中,对可逆反应A(g)+2B(g)⇌3C(g)的下列叙述中,能说明反应已达到平衡的是( )
A.混合气体的平均相对分子质量不再变化
B.单位时间内消耗a mol A,同时消耗3a molC
C.容器内的压强不再变化
D.混合气体的密度不再变化难度: 中等查看答案及解析
-
温度一定时,用水稀释0.1mol/L氨水时,溶液中随着加水量的增加而减小的是( )
A.c(OH-)
B.c(OH-)/c
C.c(H+)和c(OH-)的乘积
D.OH-的物质的量难度: 中等查看答案及解析
-
下列生活中现象与盐类水解无关的是( )
A.NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂
B.草木灰与铵态氮肥不能混合施用
C.粗盐在空气中易潮解
D.用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂难度: 中等查看答案及解析
-
下列事实不能用勒夏特列原理解释的是( )
A.将氯化铁溶液加热蒸干最终得不到氯化铁固体
B.钢铁在潮湿的空气中容易生锈
C.实验室可用排饱和食盐水的方法收集氯气
D.常温下,用水稀释烧碱溶液pH会降低难度: 中等查看答案及解析
-
已知25℃、101kPa下,如图所示,石墨的燃烧热为393.51kJ/mol,金刚石的燃烧热为395.41kJ/mol.下列说法或表达正确的是( )
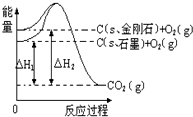
A.金刚石比石墨稳定
B.C(s、石墨)=C(s、金刚石)△H=+1.9 kJ/mol
C.△H1<△H2
D.如果使用催化剂,△H1和△H2都变小难度: 中等查看答案及解析
-
在锌与某浓度的盐酸起反应的实验中,一个学生得到下面的结果:
则下列说法正确的是( )序号 锌的质量/g 锌的形状 温度/℃ 完全溶解于酸的时间/s A 2 薄片 5 400 B 2 薄片 15 200 C 2 薄片 25 100 D 2 薄片 30 t1 E 2 薄片 35 50 F 2 颗粒 15 t2 G 2 粉末 15 t3
①t1=75s ②t2>200>t3 ③单位时间内消耗的锌的质量mG>mF>mB.
A.①
B.①②
C.只有②
D.全部正确难度: 中等查看答案及解析
-
对于可逆反应:2A(g)+B(g)⇌2C(g);△H<0,下列各图正确的是(设变化过程中物质的聚集状态没有发生改变)( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
一定条件下,可逆反应N2+3H2⇌2NH3 △H=-92.4KJ/mol,有关该反应的叙述正确的是( )
A.正催化剂能加快正反应速率v正,不影响v逆,所以缩短了反应达平衡所需的时间
B.将lmolN2和3molH2充分反应达到平衡时,放出的热量等于92.4kJ
C.当c(N2):c(H2):c(NH3)=1:3:2时,反应就达到平衡状态
D.平衡时增大氮气的浓度,达新平衡时N2转化率减小,H2转化率增大难度: 中等查看答案及解析
-
pH=13的强碱溶液与pH=2的强酸溶液混和,所得混和液的pH=11,则强酸与强碱的体积比是( )
A.11:1
B.9:1
C.1:11
D.1:9难度: 中等查看答案及解析
-
25℃时,5种银盐的溶度积常数(Ksp)分别是:
下列说法正确的是( )AgCl Ag2SO4 Ag2S AgBr AgI 1.8×10-10 1.4×10-5 6.3×10-50 7.7×10-13 8.51×10-16
A.氯化银、溴化银和碘化银的溶解度依次增大
B.将硫酸银溶解于水后,向其中加入少量硫化钠溶液,不能得到黑色沉淀
C.在5mL1.8×10-5 mol/L的NaCl溶液中,加入1滴(1mL约20滴)1.0×10-3mol/L的AgNO3溶液,能观察到白色沉淀
D.将浅黄色溴化银固体浸泡在饱和氯化钠溶液中,可以有少量白色固体生成难度: 中等查看答案及解析