-
在下列过程中,需要加快化学反应速率的是
A.钢铁腐蚀 B.工业合成氨
C.食物腐烂 D.塑料用品老化
难度: 简单查看答案及解析
-
下列反应一定属于吸热反应的是
A.酸碱中和反应
B.不需要加热就能发生的反应
C.化学键断裂吸收的能量比化学键形成放出的能量少的反应
D.氢氧化钡晶体和氯化铵晶体的反应
难度: 简单查看答案及解析
-
判断下列物质按碱性减弱、酸性增强的顺序依次排列正确的是
A.厨房清洁剂 肥皂 醋 厕所清洁剂
B.醋 厕所清洁剂 肥皂 厨房清洁剂
C.厕所清洁剂 醋 肥皂 厨房清洁剂
D.厨房清洁剂 厕所清洁剂 醋 肥皂
难度: 简单查看答案及解析
-
下列化学用语能表示水解反应的是
A.H2
O+H2O
H3O++OH-
B.HS-
+H2O
S2-+H3O+
C.S2-+H2O
HS-+OH-
D.HS-+OH-
H2O+S2-
难度: 简单查看答案及解析
-
常温时0.1 mol/L CH3COONa溶液中各离子浓度排序正确的是
A.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
C.c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
难度: 简单查看答案及解析
-
为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂过滤后,再加入适量的盐酸,这种试剂是
A.NH3·H2O B.NaOH C.Na2CO3 D.MgCO3
难度: 简单查看答案及解析
-
MnCl2溶液中常含有Cu2+离子,通过添加过量难溶电解质MnS,可使Cu2+离子形成CuS沉淀,经过滤除去包括MnS在内的沉淀,再经蒸发、结晶,可得纯净的MnCl2。根据上述实验事实,可推知MnS具有的相关性质是
A.具有吸附性 B.溶解度与CuS相同
C.溶解度大于CuS D.溶解度小于CuS
难度: 中等查看答案及解析
-
下列说法正确的是
A.pH<7的溶液一定呈酸性
B.在纯水中加入少量硫酸,可促进水的电离
C.虽然固体氯化
钠不能导电,但氯化钠是电解质
D.Na2CO3溶液中,c(Na+)是c(CO32﹣)的两倍
难度: 简单查看答案及解析
-
下列图示与对应的叙述不相符合的是

A.图甲表示强碱滴定强酸的滴定曲线
B.图乙表示酶催化反应的反应速率随反应温度的变化
C.图丙表示弱电解质在水中建立电离平衡的过程
D.图丁表示燃料燃烧反应的能量变化
难度: 中等查看答案及解析
-
以下现象与电化学腐蚀无关的是
A.纯银物品久置表面变暗
B.生铁(含有碳等杂质)比纯铁在潮湿的环境中容易生锈
C.铁质器件附有铜质配件,在接触处易生铁锈
D.黄铜(铜锌合金)制作的铜锣不易产生铜绿
难度: 简单查看答案及解析
-
利用反应2NO(g)+2CO(g)
2CO2(g)+N2(g) ∆H<0 可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是
A.降低温度 B.增大压强
C.充入N2 D.及时将CO2和N2从反应体系中移走
难度: 简单查看答案及解析
-
下列有关说法正确的是
A.为保护海轮的船壳,常在船壳上镶入锌块
B.明矾溶于水可以使水净化,是因为明矾中的Al3+水解显酸性
C.己知工业合成氨气∆H<0,达平衡后,升高温度,正反应速率减小,逆反应
速率增大
D.NH3(g) + HCl(g)=NH4Cl(s)是熵减小的反应,较低温度下能自发进行,说明该反应的∆H>0
难度: 中等查看答案及解析
-
下列关于铜电极的叙述中不正确的是
A.锌、铜电极和稀硫酸溶液构成的原电池中铜是正极
B.在镀件上镀铜时可用金属铜作阳极
C.用电解法精炼粗铜时粗铜发生氧化反应
D.用电解法精炼粗铜时纯铜作阳极
难度: 简单查看答案及解析
-
关于化学能与其他能量相互转化的说法正确的是
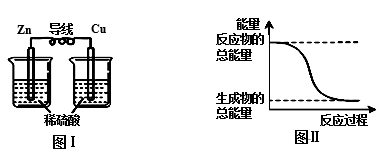
A.化学反应中能量变化的主要原因是化学键的断裂与形成
B.铝热反应属于放热反应,反应物的总能量比生成物的总能量低
C.图I所示的装置可以实现将化学能转变为电能
D.图II所示的反应为吸热反应
难度: 中等查看答案及解析
-
下列事实不能用勒夏特列原理解释的是
A.在硫化氢水溶液中加入碱有利于S2-的生成
B.加入催化剂有利于氨的氧化反应
C.高压有利于合成氨反应
D.向新制氯水中加入碳酸钙有利于次氯酸浓度增大
难度: 中等查看答案及解析
-
反应mA(s)+ nB(g)
eC(g)+ fD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是
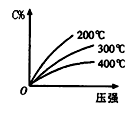
A.达到平衡后,加入催化剂则C%增大
B.达到平衡后,增加A的量有利于平衡向正向移动
C.化学方程式中n>e+f
D.达到平衡后,若升温,平衡正向移动
难度: 中等查看答案及解析
-
熔融状态下,Na的单质和FeCl2能组成可充电电池(装置示意图如下),反应原理为:2Na+FeCl2
Fe+2NaCl 。下列判断不正确的是
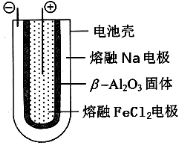
A.放电时,电池的正极反应式为Fe2++2e-=Fe
B.充电时,钠电极接电源的正极
C.该电池的电解质为
-Al2O3
D.电池在使用时,外电路中电子由负极流向正极
难度: 中等查看答案及解析
-
2.0 mol PCl3和1.0 molCl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g)
PCl5(g)达平衡时,PCl5为0.40 mol,如果此时移走1.0 mol PCl3和0.50 mol Cl2,在相同温度下再达平衡时PCl5的物质的量是
A.0.40 mol B.0.20 mol
C.小于0.20 mol D.大于0.20 mol,小于0.40 mol
难度: 困难查看答案及解析
-
一定温度下,水中存在H2O
H++OH-∆H>0的平衡,下列叙述一定正确的是
A.向水中滴入少量稀盐酸,平衡逆向移动,Kw减小
B.将水加热,Kw增大,pH减小
C.向水中加入少量CH3COONa固体,平衡逆向移动,c(H+)降低
D.向水中加入少量Na2SO4固体,平衡不移动,c(H+)一定为10-7 mol·L-1
难度: 中等查看答案及解析
-
常温下,向 100 mL0.01 mol·L-1HA 溶液中逐滴加入0.02 mol·L-1MOH 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。下列叙述一定正确的是

A.由图中信息可知HA为弱酸
B.在N点pH=7,酸碱恰好完全反应
C.常温时一定浓度的MA稀溶液显中性
D.K 点对应的溶液中,c(M+) + c(MOH)=2c (A-)
难度: 困难查看答案及解析
