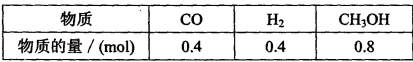
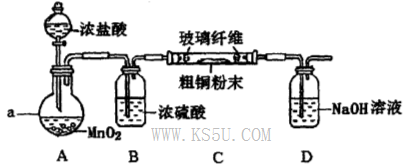
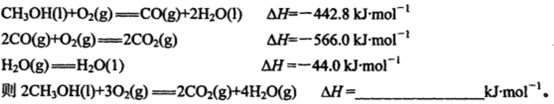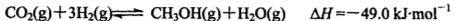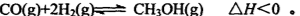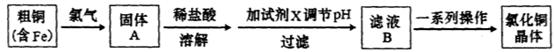-
化学在生产和生活中有着重要的应用。下列说法正确的是
A.硫酸钡在医学上用作钡餐,Ba2+对人体无毒
B.“光化学烟雾”、“雾霾天气”、“温室效应”的形成都与氮氧化物无关
C.“辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料
D.明矾[KAl(SO4)2.12H2O]水解时产生具有吸附性的胶体粒子,可作净水剂
难度: 中等查看答案及解析
-
下列说法不正确的是
A.浓硝酸与足量铜片反应时,先生成红棕色气体,后生成无色气体
B.氧化铝的熔点很高,可用于制造熔融烧碱的坩埚
C.碳具有还原性,高温下能将二氧化硅还原为硅
D.饱和氯水既有酸性又有漂白性,加入NaHCO3漂白性增强
难度: 中等查看答案及解析
-
设
为阿伏加德罗常数的值,下列说法正确的是
A.常温常压下,4g CH4含
个共价键
B.常温常压下,22.4L氦气含有的原子数为2
C.1molS在足量O2中燃烧,转移的电子数为6
D.0.1 mol/L的碳酸氢钠溶液中含钠离子数为0.1
。
难度: 中等查看答案及解析
-
能大量存在于同一溶液中,当改变条件使水电离出的时c(H+)=
mol/L,一定会发生反应的离子组是

难度: 困难查看答案及解析
-
下列反应的离子方程式书写正确的是
A.FeS固体溶于稀HNO3:
B.AlCl3和过量氨水反应:

C.向AgCI悬浊液中滴加硫化钠溶液,白色沉淀变成黑色:

D.等体积等浓度的NaHSO4与Ba(OH)2溶液混合:

难度: 困难查看答案及解析
-
已知下列转化关系中M、N均为单质,则M可能是

A. Na B.Fe C.O2 D.H2
难度: 中等查看答案及解析
-
用下图所示装置进行实验,装置正确且设计合理的是

A.用图①所示装置收集HCl气体
B.用图②所示装置配制一定物质的量浓度的硫酸
C.用图③所示装置检查该装置的气密性
D.用图④所示装置进行实验室制取的实验
难度: 中等查看答案及解析
-
中学化学常见物质甲、乙、丙、丁之间存在转化关系:甲十乙
丙十丁。下列说法正确的是
A.若甲为钠单质,丁为氢气,则乙一定是水
B.若甲为铝单质,丁为铁单质,则乙一定是氧化铁
C.若甲为铜单质,丁为氯化亚铁溶液,则乙一定是氯化铁溶液
D.若甲、乙、丙、丁均为化合物,则该反应一定属于复分解反应
难度: 困难查看答案及解析
-
短周期元素X、Y、Z、M、R在周期表中的相对位置如图所示。下列说法正确的是

A.元素X和M的氧化物对应的水化物均为强酸
B.R的单质能与M的氢化物发生置换反应
C.气态氢化物的稳定性:M>Y
D.元素Y、Z形成的简单离子半径大小关系为:Z>Y
难度: 简单查看答案及解析
-
下列说法正确的是
A.将pH=4的盐酸稀释后,溶液中所有离子的浓度均降低
B.0.l0mol/L的氨水加水稀释后,溶液中c(NH4+) ·c(OH-)变大
C.常温下,向水中加入少量Na2CO3固体后,c(H+)会减小,但Kw不变
D.若
LpH=11的NaOH溶液与
LpH=3的HA溶液混合后显中性,则
≤
难度: 中等查看答案及解析
-
铅蓄电池是一种用途极广的二次电池,其电池反应为:

下列说法不正确的是
A.放电时,负极质量增加
B.充电时,应将外接直流电源的正极与蓄电池的铅电极相接
C.放电时,正极反应为:

D.铅蓄电池做电源电解Na2SO4溶液时,当有lmolO2产生时,消耗4molH2SO4
难度: 困难查看答案及解析
-
下列说法中正确的是
A.在船体上镶嵌锌块,可以减缓船体被海水腐蚀的速率
B.粗铜精炼时,电镀液中的c(Cu2+)保持不变
C.纯银在空气中久置变黑发生的是电化学腐蚀
D.阴极电保护法是将被保护的金属与外加电源的正极相连
难度: 中等查看答案及解析
-
下列有关电解质溶液中微粒浓度关系不正确的是
A.0.lmol/LpH=4的NaHA溶液中:
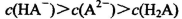
B.1mol/L的NaHCO3溶液中:
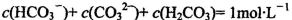
C.常温下,pH=7的NH4Cl与氨水的混合溶液中:
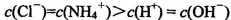
D.等体积、等物质的量浓度的NaX和弱酸HX的混合溶液中:

难度: 困难查看答案及解析
-
下列实验操作、现象和结论正确的是

难度: 中等查看答案及解析
-
下列图示与对应的叙述相符的是
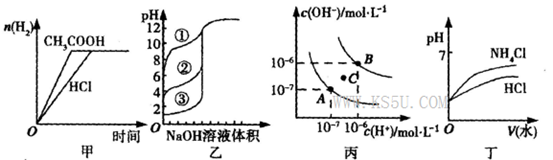
A.图甲中曲线表示向等体积、等物质的量浓度的盐酸和醋酸溶液中,分别加入足量镁粉,产生H2的物质的量的变化
B.图乙表示将0.10 mol/LNaOH溶液分别滴加到浓度相同的三种一元酸中,由图可知③的酸性最强
C.图丙为水的电离平衡曲线,若从A点到C点,可采用在水中加入适量NaOH固体的方法
D.图丁中曲线表示将pH相同的NH4Cl溶液和稀盐酸稀释相同倍数时,二者pH的变化向容积均为0.5L的
难度: 困难查看答案及解析
-
甲、乙、丙三个密闭容器中分别充入一定量的A和B,发生反应:
 。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如下图表所示:
。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如下图表所示:
下列说法正确的是
A.
,且该反应为吸热反应
B.x=2
C.若平衡后保持温度不变,改变容器体积平衡不移动
D.
℃下,若起始时向甲容器中充入0.5molA、1.5molB,平衡时A的转化率为25%
难度: 困难查看答案及解析