-
化学与生活、生产息息相关,下列说法错误的是
A.硅酸钠属于硅酸盐,是普通玻璃的成分之一
B.铝合金的大量使用归功于工业上用一氧化碳还原氧化铝生产铝
C.黄铜(铜锌合金)制作的铜锣不易产生铜绿
D.食盐可做调味剂,也可做防腐剂
难度: 中等查看答案及解析
-
下列叙述正确的是
A.将SO2通入酸性高锰酸钾溶液中,溶液褪色,说明SO2具有漂白性
B.相同温度下,完全中和相同PH、相同体积的氨水和NaOH溶液,所需相同浓度的盐酸体积相等
C.0.1mol·L-1的酸式盐NaHA溶液中,c(Na+)=0.1mol·L-1≥c(A2-)
D.向KI溶液中加入氯化银,沉淀逐渐变黄色,说明同温下
难度: 中等查看答案及解析
-
有A、B、C三种短周期元素,质子数之和为31。若C为Ar,则关于A、B两种元素的说法中正确的是
A.如果A是金属元素,则B一定是稀有气体元素
B.如果A元素是氟,则B元素是硼
C.如果A的气态氢化物的水溶液显碱性,则B的气态氢化物的水溶液显酸性
D.如果A的最高正价是+3,则B的单质有两种常见的同素异形体
难度: 中等查看答案及解析
-
下列涉及有机物的说法中正确的是
A.煤的干馏可得到苯、甲苯等芳香烃
B.乙烯、氯乙烯都是不饱和烃,均可用于合成有机高分子材料
C.在加热条件下,加入适量乙醇以除去乙醇乙酯中含有的乙酸杂质
D.淀粉和纤维的水解产物都是葡萄糖,二者互为同分异构体
难度: 中等查看答案及解析
-
下列叙述正确的是(设NA为阿伏加德罗常数的数值)
A.1 mol羟基中含有10 NA个电子
B.标准状况下,2.24 L苯中含有0.6NA个碳原子
C.常温常压下,46g NO2和N2O4混合气体中含有的原子总数为3NA
D.1 mol Fe和稀稀硝酸反应生成NO气体,转移2NA个电子
难度: 中等查看答案及解析
-
下列各组离子在指定条件下,一定能大量共存的是
A.能使蓝色石蕊试纸变红色的溶液:
、
、
、
B.c(H+)=0.1mol·L-1的透明溶液:
、
、
、
C.能使氢氧化铝溶解的溶液:
、
、
、
D.水电离出的
的溶液:
、
、
、
难度: 中等查看答案及解析
-
下列有关实验的结论正确的是
选项 实验操作及现象 实验结论
A 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 溶液中一定含有
B 向某溶液中加入盐酸,产生能使澄清石灰水变浑浊的无色气体 溶液中一定含有
C 用酸度计测定SO2和CO2饱和溶液的pH,前者pH小 H2SO3酸性强于H2CO3
D 用玻璃棒蘸取浓氨水点到红色石蕊试纸上,试纸变蓝色 浓氨水呈碱性
难度: 中等查看答案及解析




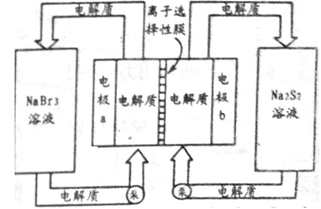
 ,电解质通过泵在储罐和电池间循环;离子选择性膜只允许钠离子通过。
,电解质通过泵在储罐和电池间循环;离子选择性膜只允许钠离子通过。