-
化学与生活密切相关。下列应用中利用了物质氧化性的是( )
A.明矾净化水 B.纯碱去油污
C.食醋除水垢 D.漂白粉漂白织物
难度: 中等查看答案及解析
-
下列离子中半径最大的是( )
A.Na+ B.Mg2+ C.O2- D. F-
难度: 中等查看答案及解析
-
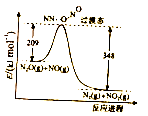
0.1mol下列气体分别与1L0.lmol·L-1的NaOH溶液反应,形成的溶液pH最小的是( )
A.NO2 B.SO2 C.SO3 D.CO2
难度: 中等查看答案及解析
-
己知丙烷的燃烧热△H=-2215KJ·mol-1,若一定量的丙烷完全燃烧后生成1.8g水,则放出的热量约为( )
A.55 kJ B.220 kJ C. 550 kJ D.1108 kJ
难度: 中等查看答案及解析
-
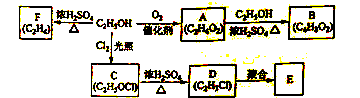
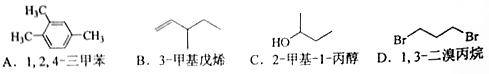
分子式为C4H10O并能与金属钠反应放出氢气的有机物有(不含立体异构)( )
A.3种 B. 4种 C. 5种 D.6种
难度: 中等查看答案及解析
-
己知在碱性溶液中可发生如下反应:
2R(OH)3 + 3C1O- + 4OH- = 2RO4n-+3Cl- +5H2O。则RO4n-中R的化合价是( )
A.+3 B. +4 C. +5 D.+6
难度: 中等查看答案及解析
-
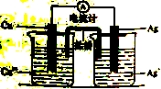
下列叙述正确的是( )
A.稀盐酸可除去烧瓶内残留的MnO2 B.可用磨口玻璃瓶保存NaOH溶液
C.稀硝酸可除去试管内壁的银镜 D.煮沸自来水可除去其中的Ca(HCO3)2
难度: 中等查看答案及解析
-
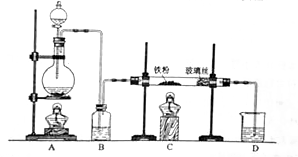
10ml浓度为1mol/L的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气生成的是( )
A.K2SO4 B.CH3COONa C.CuSO4 D.Na2CO3
难度: 中等查看答案及解析
-
下列反应不属于取代反应的是( )
A.淀粉水解制葡萄糖 B.石油裂解制丙烯
C.乙醇与乙酸反应制乙酸乙酯 D.油脂与浓NaOH反应制高级脂肪酸钠
难度: 中等查看答案及解析
-
下列指定微粒的数目相等的是( )
A.等物质的量的水与重水含有的中子数
B.等质量的乙烯和丙烯中含有的共用电子对数
C.同温、同压同体积的CO和NO含有的质子数
D.等物质的量的铁和铝分别于足量氯气完全反应时转移的电子数
难度: 中等查看答案及解析
-
下列曲线中,可以描述乙酸(甲,Ka=1.8×10-5)和一氯乙酸(乙,Ka=1.4×10-3)在水中的电离度与浓度关系的是( )

难度: 中等查看答案及解析
-
a、b、c、d为短周期元素,a的M电子层有1个电子,b的最外层电子数为内层电子数的2倍,c的最高化合价为最低化合价绝对值的3倍,c与d同周期,d的原子半径小于c。下列叙述错误的是( )
A.d元素的非金属性最强
B.它们均存在两种或两种以上的氧化物
C.只有a与其他元素生成的化合物都是离子化合物
D.b、c、d与氢形成的化合物中化学键均为极性共价键
难度: 中等查看答案及解析