-
下列关于物质分类的正确组合是( )
组合
分类碱 酸 盐 碱性氧化物 酸性氧化物 A 纯碱 盐酸 烧碱 氧化铝 二氧化硫 B 烧碱 硫酸 食盐 氧化铁 二氧化氮 C 苛性钠 石炭酸 硫酸铵 过氧化钠 二氧化硅 D 苛性钾 硬脂酸 小苏打 氧化钙 五氧化二磷
A.选项A
B.选项B
C.选项C
D.选项D难度: 中等查看答案及解析
-
下列有关说法不正确的是(NA表示阿伏加德罗常数)( )
A.向硫酸酸化的KMnO4溶液中滴加BaCl2溶液,会产生白色沉淀和黄绿色气体
B.室温下,42.0g乙烯和丁烯的混合气体中含有的碳原子数为3NA
C.CO32-离子的VSEPR模型为平面三角形
D.19.5gNa2O2投入过量的水中,反应中转移的电子数为0.5NA难度: 中等查看答案及解析
-
下列离子方程式书写不正确的是( )
A.向100mL 1 mol/L溴化亚铁溶液中通入标准状况下的2.24L氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
B.硫酸亚铁溶液与稀硫酸、双氧水混合:Fe2++H2O2+2H+=Fe3++2H2O
C.碳酸钙溶于硝酸:CaCO3+2H+=Ca2++CO2↑+H2O
D.碳酸氢钠溶液与少量石灰水反应:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O难度: 中等查看答案及解析
-
难溶物BaSO4在水中的溶解平衡可表示为:BaSO4(s)⇌Ba2+(aq)+SO42-(aq).其溶度积常数Ksp=C(Ba2+)•C(SO42-),某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
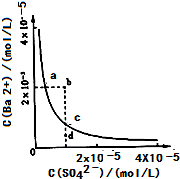
A.d点无BaSO4沉淀生成
B.加入Na2SO4可以使溶液由a点变到b点
C.通过蒸发可以使溶液由d点变到c点
D.a点对应的Ksp大于c点对应的Ksp难度: 中等查看答案及解析
-
常温下,下列溶液中各微粒浓度关系不正确的是( )
A.PH相等的①CH3COONa②C6H5ONa③NaHCO3溶液中,C(Na+)大小关系:①>③>②
B.向氨水中滴加稀硫酸至溶液呈中性:C(NH4+)>C(SO42-)>C(OH-)=C(H+)
C.向1L 0.1mol/L的NaOH溶液中通入6.6gCO2:2C(Na+)=3[C(CO32-)+C(HCO3-)+C(H2CO3)]
D.CH3COONa溶液中加入少量KNO3后的碱性溶液一定有:C(Na+)+C(H+)=C(CH3COO-)+C(OH-)难度: 中等查看答案及解析
-
NO、NO2、O2按照一定比例通入水中,能被完全吸收,无剩余气体,若NO、NO2、O2的气体体积分别为a、b、c、则a:b:c可能为( )
A.1:5:2
B.2:5:1
C.5:1:2
D.5:2:1难度: 中等查看答案及解析
-
一定温度下,向体积为2L的恒容密闭容器中充入1mol PCl5(g),发生反应:
PCl5(g)⇌PCl3(g)+Cl2(g)△H=+Q KJ/mol维持容器温度不变,测得容器内压强随反应时间的变化如图所示.下列说法正确的是( )
A.3s内的平均速率为:V(PCl3)=0.1mol•L-1•min-1
B.达到平衡时放出0.6QKJ热量
C.其他条件不变,再向容器中充入1molPCl5(g),则达新平衡时,C(PCl5)>0.4mol•L-1
D.其他条件不变,增大PCl5的浓度,平衡常数减小难度: 中等查看答案及解析