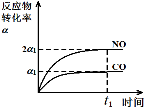
-
下列电池属于二次电池的是




A. 锌银钮扣电池
B.氢氧燃料电池
C.铅蓄电池
D.锌锰干电池
难度: 中等查看答案及解析
-
某同学组装了如图所示的原电池装置,下列叙述中正确的是
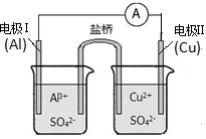
A.电流方向:电极Ⅱ→→电极Ⅰ
B.电极Ⅱ逐渐溶解
C.电极Ⅰ上发生还原反应
D.盐桥中装有含氯化钾的琼脂,Cl¯向右池移动
难度: 简单查看答案及解析
-
下列与金属腐蚀有关的说法中,不正确的是
A.钢铁在潮湿空气中生锈属于电化学腐蚀
B.电化学腐蚀一般可分为吸氧腐蚀和析氢腐蚀
C.金属腐蚀的本质是金属原子失去电子被氧化的过程
D.铝具有强抗腐蚀能力,是因为其不易与氧气发生反应
难度: 简单查看答案及解析
-
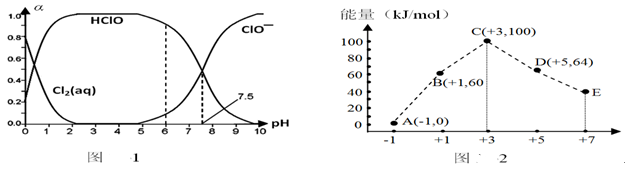
关于0.1mol·L-1NaHCO3溶液,下列说法正确的是
A.溶质水解反应:HCO3- +H2O
H3O++CO32-
B.离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-)
C.微粒浓度关系:c(Na+)>c(HCO3-) >c(H2CO3)>c(CO32-)
D.微粒浓度关系:c(Na+)=2[c(H2CO3)+c(HCO3-)+c(CO32-)]
难度: 简单查看答案及解析
-
下列叙述正确的是
A.Na在足量O2中燃烧,消耗l mol O2时转移的电子数是4×6.02×1023
B.盐酸和醋酸的混合溶液pH=1,该溶液中c(H+) = 0.1 mol/L
C.1 L 0.1 mol/L NH4Cl溶液中的NH
数是0.1×6.02×1023
D.标准状况下2.24 L Cl2中含有0.2 mol 共价键
难度: 简单查看答案及解析
-
N2(g)+3H2(g)
2NH3(g)△H<0。当反应达到平衡时,下列措施能提高N2转化率的是
① 降温 ② 恒压通入惰性气体 ③ 增加N2的浓度 ④ 加压
A.①④ B.①② C.②③ D.③④
难度: 简单查看答案及解析
-
常温下,若HA溶液和NaOH溶液混合后pH =7,下列说法不合理的是
A.反应后HA溶液可能有剩余
B.生成物NaA的水溶液的pH可能小于7
C.HA溶液和NaOH溶液的体积可能不相等
D.HA溶液的c(H+)和NaOH溶液的c(OH -)可能不相等
难度: 简单查看答案及解析
-
关于常温下0.1 mol/L氨水(pH=11.12)的下列说法不正确的是
A. 加水稀释过程中,c(H+)/c(OH-) 的值增大
B. 根据以上信息,可推断NH3·H2O为弱电解质
C. 与pH=11.12的 NaOH溶液相比,NaOH溶液中c(Na+) 大于氨水中c(NH
)
D.加入少量NH4Cl 固体,溶液中水的电离平衡:H2O ⇌ H+ + OH-正向移动
难度: 简单查看答案及解析
-
LED产品的使用为城市增添色彩。下图是氢氧燃料电池驱动LED发光的一种装置示意图。下列有关叙述正确的是
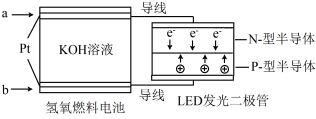
A.a处通入O2
B.b处为电池正极,发生了还原反应
C.通入O2的电极发生反应:O2+4e-+4H+ = 2H2O
D.该装置将化学能最终转化为电能
难度: 困难查看答案及解析
-
下列措施能明显增大原反应的化学反应速率的是
A.Na与水反应时增大水的用量
B.将稀H2SO4改为98%的浓H2SO4与Zn反应制取H2
C.在H2SO4与NaOH两溶液反应时,增大压强
D.恒温恒容条件下,在工业合成氨反应中,增加氮气的量
难度: 简单查看答案及解析
-
关于下列装置的说法正确的是

① ②
A.①中盐桥内的K+移向CuSO4溶液
B.①将电能转变为化学能
C.若②用于铁棒镀铜,则N极为铁棒
D.若②用于电解精炼铜,溶液中的Cu2+浓度保持不变
难度: 中等查看答案及解析
-
下列关于各图像的解释或结论正确的是
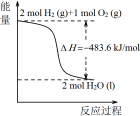
甲 乙 丙 丁
A.由甲可知:热化学方程式是H2(g) +
O2(g) = H2O(g) △H=﹣241.8kJ/mol
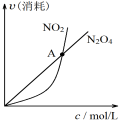
B.由乙可知:对于恒温恒容条件下的反应2NO2(g) ⇌ N2O4(g),A点为平衡状态
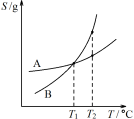
C.由丙可知:将A、B饱和溶液分别由T1 ℃升温至T2 ℃时,溶质的质量分数B>A
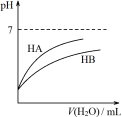
D.由丁可知:同温度、同浓度的NaA溶液与NaB溶液相比,其pH前者小于后者
难度: 简单查看答案及解析
-
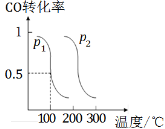
已知:某元素X的酸式盐(NaHX)溶液显碱性,下列说法正确的是
A.NaHX的电离方程式为NaHX=== Na+ + H+ + X2¯
B.HX¯的电离程度小于HX¯的水解程度
C.离子浓度关系:c(Na+) + c(H+) = c(OH¯) + c(HX¯) + c(X2¯)
D.加水稀释,促进HX¯水解,c(HX¯)增大
难度: 简单查看答案及解析
-
室温下,下列有关两种溶液的说法不正确的是
序号
①
②
pH
12
12
溶液
氨水
氢氧化钠溶液
A.①②两溶液中c(OH-)相等
B.①溶液的物质的量浓度为0.01mol·L-1
C.①②两溶液分别加水稀释10倍,稀释后溶液的pH:①>②
D.等体积的①②两溶液分别与0.01 mol·L-1的盐酸完全中和,消耗盐酸的体积:①>②
难度: 中等查看答案及解析
-
单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点越高。下列溶液中沸点最高的是
A.0.01 mol/L的蔗糖溶液 B.0.01 mol/L的K2SO4溶液
C.0.02 mol/L的NaCl溶液 D.0.02 mol/L的CH3COOH溶液
难度: 简单查看答案及解析
-
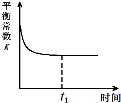
工业上用CO和H2合成CH3OH:CO(g)+2H2(g)
CH3OH(g)。反应的平衡常数如下表:
温度/℃
0
100
200
300
400
平衡常数
667
13
1.9×10-2
2.4×10-4
1×10-5
下列说法正确的是
A.该反应的△H> 0
B.加压、增大H2浓度和加入催化剂都能提高CO的转化率
C.工业上采用5 ×103 kPa和250℃的条件,其原因是原料气的转化率高
D.t℃时,向1 L密闭容器中投入0.1 mol CO和0.2 mol H2,平衡时CO转化率为50%,则该温度时反应的平衡常数的数值为100
难度: 简单查看答案及解析