-
叠氮酸(HN3)与醋酸酸性相似,下列叙述中错误的是( )
A.水溶液中微粒浓度大小顺序为:c(HN3)>c(H+)>c(N3-)>c(OH-)
B.HN3与NH3作用生成的叠氮酸铵是共价化合物
C.NaN3水溶液中离子浓度大小顺序为: c(Na+)>c(N3-) >c(OH-)>c(H+)
D.N3-与CO2含有的电子数相等
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.氯化钾溶液在电流作用下电离成钾离子和氯离子
B.二氧化硫溶于水能部分转化成离子,故二氧化硫属于弱电解质
C.硫酸钡难溶于水,所以硫酸钡属弱电解质
D.纯净的强电解质在液态时,有的导电有的不导电
难度: 中等查看答案及解析
-
要准确量取25.00ml的稀盐酸,可用的仪器是( )
A、25ml的量筒 B、25ml的酸式滴定管 C、25ml的碱式滴定管 D、25ml的烧杯
难度: 中等查看答案及解析
-
在相同温度时100mL0.01mol/L的醋酸溶液与10mL0.1mol/L的醋酸溶液相比较,下列数值前者大于后者的是( )
A.中和时所需NaOH的量 B.由水电离出的[H+] C.H+的浓度 D.CH3COOH的物质的量
难度: 中等查看答案及解析
-
设NA代表阿伏加德罗常数的数值,下列说法正确的是( )
①常温常压下,17g甲基(-14CH3)所含的中子数为9NA;②常温常压下,22.4LNO气体的分子数小于NA; ③64g铜发生氧化还原反应,失去2 NA个电子;④常温常压下,100ml 0.5mol/l的乙酸溶液中,乙酸分子数目小于0.05NA;⑤标况下,22.4LCH2Cl2所含有的分子数为NA;⑥常温常压下,1mol氦气含有的核外电子数为4 NA;
A、②④ B、①② C、③④ D、⑤⑥
难度: 中等查看答案及解析
-
把一定浓度的NaOH溶液分成两等份,一份密闭保存,另一份敞口放置,几天后用相同浓度的盐酸去中和它们,至溶液中只有NaCl时,若第一份用去盐酸V1 mL,第二份用去盐酸V2 mL。则V1 和V2的关系正确的是( )
A. V1 <V2 B. V1 =V2 C. V1 >V2 D. 不一定
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.PH=2与PH=1的硝酸中c(H+)之比为 1:10
B.Na2CO3溶液中c(Na+)与c(CO32-)之比为2:1
C.0.2 mol·l-1与0.1 mol·l-1醋酸中c(H+)之比为2:1
D.NO2溶于水时,被氧化的n(NO2)与被还原的n(NO2)之比为3:1
难度: 中等查看答案及解析
-
将3.72g金属钠、氧化钠和过氧化钠的混合物与足量水反应,在标准状况下得到672mL混合气体,将混合气体电火花点燃,恰好完全反应,则原混合物中钠、氧化钠、过氧化钠的物质的量之比为( )
A.3:2:1 B.4:2:1 C.1:1:1 D.2:1:1
难度: 中等查看答案及解析
-
用下列溶质配制某混合溶液,已知溶液中〔K+〕=〔Cl-〕,1/2〔Na+〕=〔SO42-〕,则其溶质可能是( )
A.KCl,NaHSO4 B.KCl,Na2SO4,NaCl C.NaCl,KCl,K2SO4 D.KCl,K2SO4,Na2SO4
难度: 中等查看答案及解析
-
在[Pb2+]为0.200mol/L的溶液中,若每升加入0.201mol的Na2SO4(设条件不变), 留在溶液中的Pb2+的百分率是(已知PbSO4的Ksp=1.8×10-8) ( )
A.1×10-3% B.2×10-4% C.9×10-3% D.2.5×10-20%
难度: 中等查看答案及解析
-
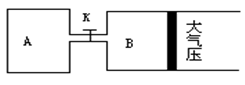
一定温度下可逆反应:A(s)+2B(g)
2C(g)+D(g);△H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是( )
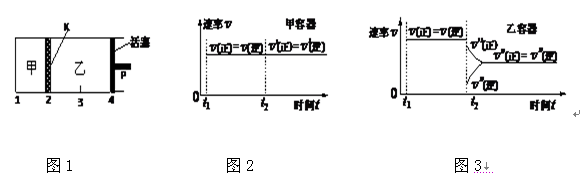
A、保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度与乙中C的浓度相等
B、保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,甲、乙中B的体积分数均增大
C、保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍
D、保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略)
难度: 中等查看答案及解析
-
下列变化属于吸热反应的是( ).
①液态水气化 ②将胆矾加热变为白色粉末 ③浓硫酸稀释 ④氯酸钾分解制氧气 ⑤生石灰与水反应生成熟石灰 ⑥水煤气反应 ⑦二氧化碳与赤热的炭反应生成一氧化碳
A.①④⑤⑦ B.②③⑥ C. ①②④⑦ D.②④⑥⑦
难度: 中等查看答案及解析
-
胶状液氢(主要成分是H2和CH4)有望用于未来的运载火箭和空间运输系统。实验测得:101kPa时,1mol H2完全燃烧生成液态水,放出285.8kJ的热量;1 mol CH4完全燃烧生成液态水和CO2,放出890.3kJ的热量。下列热化学方程式书写正确的是( )
A.CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H=-890.3kJ·mol—1
B.1/2CH4(g)+O2(g)=1/2CO2(g)+H2O(l);△H=-445.15kJ·mol—1
C.CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-890.3kJ
D.2H2(g)+O2(g)=2H2O(l);△H=-285.8kJ·mol—1
难度: 中等查看答案及解析
-
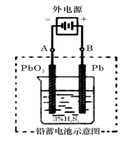
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
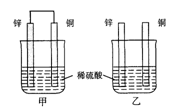
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速度甲比乙慢
难度: 中等查看答案及解析
-
我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流。总反应为:4Al+3O2+6H2O=4Al(OH)3,下列说法不正确的是( )
A.正极反应为:O2+2H2O+4e-=4OH-
B.电池工作时,电流由铝电极沿导线流向铂电极
C.以网状的铂为正极,可增大与氧气的接触面积
D.该电池通常只需要更换铝板就可继续使用
难度: 中等查看答案及解析
-
在合成氨反应中,经过5秒钟,NH3的浓度增加了1.5mol·L-1,在这5秒钟内,下列平均反应速率正确的是 ( )
① v(NH3)=0.15 mol·L-1·s-1 ② v(H2)=0.45 mol·L-1·s-1
③ v(N2)=0.15 mol·L-1·s-1 ④ v(H2)=0.3mol·L-1·s-1
A、①② B、②③ C、③④ D、 ①④
难度: 中等查看答案及解析
-
查处酒后驾驶采用的“便携式乙醇测量仪”以燃料电池为工作原理,在酸性环境中,理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为X,其中一个电极的反应式为:CH3CH2OH-2e-→X+2H+。下列说法中正确的是 ( )
A.电池内部H+由正极向负极移动
B.另一极的电极反应式为:O2 + 4e- + 2H2O = 4OH-
C.乙醇在正极发生反应,电子经过外电路流向负极
D.电池总反应为:2CH3CH2OH+O2→2CH3CHO+2H2O
难度: 中等查看答案及解析
-
有一瓶14%的KOH溶液,加热蒸发掉100g水后,变为28%的KOH溶液80mL,这80mL溶液的物质的量浓度为( )
A.5mol/L B.6mol/L C.6.25mol/L D.6.75mol/L
难度: 中等查看答案及解析
-
温度体积固定的容器中建立2NO2
N2O4平衡,平衡时NO2与N2O4物质的量浓度之比为Φ,条件不变的情况下,分别再充入NO2和再充入N2O4,平衡后会引起Φ的变化正确的是:( )
A. 都引起Φ增大 B. 充入NO2引起Φ增大,充入N2O4引起Φ减小
C. 都引起Φ减小 D. 充入NO2引起Φ减小,充入N2O4引起Φ增大
难度: 中等查看答案及解析
-
一定温度下,在体积不变的密闭容器中,可逆反应2NO2(g)
2NO(g)+O2(g),达到平衡的标志 ( )
①单位时间内生成n mol O2的同时生成2n NO2(g)
②单位时间内生成n mol O2的同时生成2n NO(g)
③用NO2、NO、O2的物质的量浓度变化表示反应速率之比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A.①④⑥ B.②③⑤ C.①③④ D.①②③④⑤⑥
难度: 中等查看答案及解析