-
《中国诗词大会》不仅弘扬了中国传统文化,还蕴含着许多化学知识,下列诗词分析不正确的是
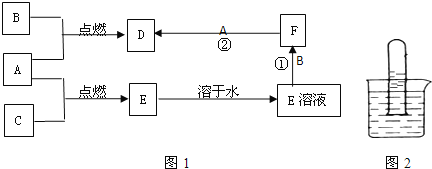
A. 李自诗句“日照香炉生紫烟,遥看瀑布挂前川”, “紫烟”指“香炉”中碘升华的现象
B. 刘禹锡诗句“千淘万漉虽辛苦,吹尽狂沙始到金”,金性质稳定,可通过物理方法得到
C. 王安石诗句“爆竹声中一岁除,春风送暖入屠苏”,爆竹的燃放涉及氧化还原反应
D. 曹植诗句“煮豆燃豆萁,豆在釜中泣”,这里的能量变化主要是化学能转化为热能。
难度: 中等查看答案及解析
-
中国传统文化对人类文明贡献巨大。下列古代文献设计化学研究成果,对其说明不合理的是
目的
古代文献
说明
A
使用
《周礼》:“煤饼烧蛎房(牡蛎壳)成灰”,蔡伦造纸用此“灰”溶于水沤浸树皮脱胶。
“灰”的主要成分是氧化钙
B
鉴别
《新修本草》:硝石“如握盐雪不冰,强烧之,紫青烟起”,用于区分硝石(KNO3)和朴硝(Na2SO4)
利用焰色反应
C
浸出
《肘后备急方》:“青蒿一握,以水二升渍,绞取汁,尽服之”。
提取青蒿素中的纤维素
D
性质
《本草纲目》:“(火药)乃焰消(KNO3)、硫磺、杉木炭所合,以为烽燧机诸药者”。
利用KNO3的氧化性
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 14 g乙烯和丙烯混合气体中的氢原子数为2NA
B. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C. 1 mol Fe溶于过量硝酸,电子转移数为2NA
D. 标准状况下,2.24 L CCl4含有的共价键数为0.4NA
难度: 中等查看答案及解析
-
下列各组离子在指定溶液中能大量共存的是( )。
A. 无色溶液中:K+、Na+、MnO4-、SO42-
B. 酸性溶液中:Fe2+、Al3+、NO3-、I-、Cl-
C. 加入Al能放出H2的溶液中:HCO3-、NO3-、Mg2+、Na+
D. pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
难度: 中等查看答案及解析
-
将0.56克KOH和1.38克K2CO3混合并配成溶液,向溶液中滴加0.1mol•L-1稀盐酸.下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
A.
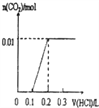 B.
B. 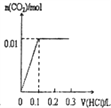 C.
C.  D.
D. 
难度: 中等查看答案及解析
-
已知常温下,在溶液中发生如下反应:①16H++10Z-+2XO4-=2X2++5Z2+8H2O;②2A2++B2=2A3++2B-;③2B-+Z2=B2+2Z-由此推断下列说法错误的是( )。
A. 反应Z2+2A2+=2A3++2Z-可以进行
B. Z元素在①反应中被氧化,在③反应中被还原
C. 还原性由强到弱的顺序是Z-,B-,A2+,X2+
D. 氧化性由强到弱的顺序是XO4-,Z2,B2,A3+
难度: 中等查看答案及解析
-
已知硫酸亚铁溶液中加入过氧化钠时发生反应:4Fe2++4Na2O2+6H2O=4Fe(OH)3↓+O2↑+8Na+,则下列说法正确的是
A. 该反应中Na2O2既是氧化剂又是还原剂,O2是还原产物
B. 若Fe2+失去4mol电子,生成氧气的体积约为22.4L
C. 4 mol Na2O2在反应中共得到6NA个电子
D. 反应过程中可以看到白色沉淀先转化为灰绿色后转化为红褐色
难度: 中等查看答案及解析
-
如图是用于干燥、收集并吸收多余气体的装置,下列方案正确的是( )
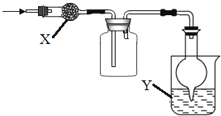
选项
X
收集气体
Y
A
碱石灰
氯气
水
B
碱石灰
氨气
水
C
氯化钙
二氧化硫
氢氧化钠
D
氯化钙
一氧化氮
氢氧化钠
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑。A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,下列有关说法正确的是

A. X使蔗糖变黑的现象主要体现了X的强氧化性
B. 若A为铁,则足量A与X在室温下即可完全反应
C. 若A为碳单质,则将C通入少量的澄清石灰水,一定可以观察到白色沉淀产生
D. 工业上,B转化为D的反应条件为高温、常压、使用催化剂
难度: 中等查看答案及解析
-
在学习中,我们经常应用类推法。下列表格左边正确,类推法应用于右边也正确的是( )
A
向FeCl2溶液中滴入氯水
2Fe2++ Cl2=2Fe3+ + 2Cl-
向FeCl2溶液中滴入碘水
2Fe2++ I2=2Fe3++2I-
B
CO2通入漂白粉溶液中
CO2+Ca2++2ClO-+H2O=CaCO3↓+ 2HClO
SO2通入漂白粉溶液中
SO2+Ca2++2ClO-+H2O=CaSO3↓+2HClO
C
向Na2CO3溶液中滴入稀HNO3
CO32-+2H+=CO2↑+ H2O
向Na2SO3溶液中滴入稀HNO3
SO32-+2H+=SO2↑+H2O
D
向澄清石灰水中通入少量CO2 气体
Ca2++2OH-+CO2=CaCO3↓+ H2O
向澄清石灰水中通入少量SO2气体
Ca2++2OH- +SO2= CaSO3↓+H2O
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
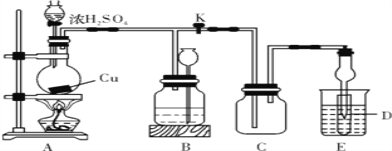
某兴趣小组探究SO2气体还原Fe3+的反应,他们使用的药品和装置如下图所示,下列说法不合理的是( )
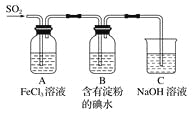
A. 能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色
B. 装置C的作用是吸收多余的SO2,防止污染空气
C. 为了验证A中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2,产生白色沉淀
D. 为了验证A中发生了氧化还原反应,加入酸性KMnO4溶液,紫红色褪去
难度: 困难查看答案及解析
-
下列除杂所选用的试剂及操作方法均正确的一组是(括号内为杂质)( )
选项
待提纯的物质
除杂的试剂
操作方法
A
NO2(NO)
O2
收集气体
B
CO2(HCl)
饱和Na2CO3溶液
洗气
C
FeCl2溶液(FeCl3)
足量铁粉
过滤
D
KCl溶液(MgCl2)
NaOH溶液
过滤
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
某硫酸厂废气中SO2的回收利用方案如图所示.下列说法不正确的是( )

A. X可能含有2种盐
B. 气体a通入双氧水,可实现“绿色”转化
C. Y主要含有(NH4)2SO4,回收利用作化肥
D. (NH4)2S2O8中S的化合价为+7
难度: 困难查看答案及解析
-
甲、乙、丙、丁均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去),下列各组物质中不能按图示关系转化的是( )
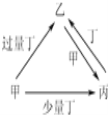
选项
甲
乙
丙
丁
A
NaOH
NaHSO3
Na2SO3
SO2
B
AlCl3
Na[Al(OH)4]
Al(OH)3
NaOH
C
Fe
Fe(NO3)3
Fe(NO3)2
HNO3
D
C
CO
CO2
O2
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
海水开发利用的部分过程如图所示。下列说法错误的是
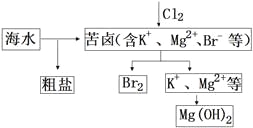
A. 向苦卤中通入Cl2是为了提取溴
B. 获取金属Mg可采用电解MgCl2溶液的方法
C. 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
D. 粗盐可采用除杂和重结晶等过程提纯
难度: 中等查看答案及解析
-
在如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.a和b分别是( )
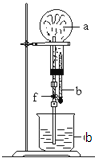
a(干燥气体)
b(液体)
①
NO2
水
②
CO2
4mol•L-1NaOH溶液
③
Cl2
饱和食盐水
④
NH3
l mol•L-1盐酸
A. ①和② B. ③和④ C. ①和③ D. ②和④
难度: 简单查看答案及解析
-
向150mL一定浓度的HNO3中加入44.8 铜片,一段时间后,铜片完全溶解,硝酸恰好完全反应,共收集到气体(NO、NO2)22.4L(已折算成标准状况),则该HNO3的物质的量浓度是( )
A. 10.0mol•L-1 B. 16.0mol•L-1 C. 12.4mol•L-1 D. 18.7mol•L-1
难度: 中等查看答案及解析
-
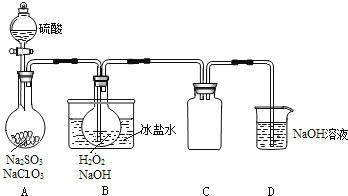
如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )
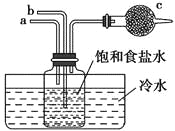
A. a通入CO2,然后b通入NH3,c中放碱石灰
B. b通入NH3,然后a通入CO2,c中放碱石灰
C. a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D. b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
难度: 中等查看答案及解析
-
下列实验合理的是( )
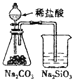


A、证明非金属性Cl>C>Si
B、吸收氨气,并防止倒吸
C、制备并收集少量NO2气体
D、制备少量氧气
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
元素X的单质及X与元素Y形成的化合物存在如图所示的关系(其中m≠n,且均为正整数).下列说法正确的是( )

A. X一定是金属元素
B. (n-m)一定等于1
C. 由X生成1molXYm时转移的电子数目一定为4NA
D. 三个化合反应一定都是氧化还原反应
难度: 极难查看答案及解析
-
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br- 2Fe3++2I-═2Fe2++I2,则下列有关说法中,不正确的是( )
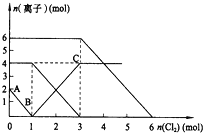
A. 还原性:I->Fe2+>Br-
B. 当通入2molCl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2═2Fe3++I2+4Cl-
C. 原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3
D. 原混合溶液中FeBr2的物质的量为2mol
难度: 困难查看答案及解析