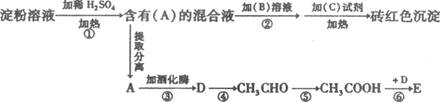
-
能用分液漏斗分离的是( )
A.甘油和水 B.溴苯和水 C.乙醇和溴水 D.乙醇和乙酸
难度: 简单查看答案及解析
-
下列说法中正确的是( )
A.石油裂解可以得到氯乙烯
B.石油的裂化是为了得到乙烯和丙烯
C.煤的干馏发生了化学变化
D.煤中含有苯和甲苯,可以通过先干馏后分馏的方法得到苯和甲苯
难度: 简单查看答案及解析
-
下表中所示物质或概念间的从属关系一定符合右图的是( )
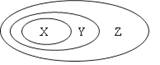
X
Y
Z
A.
钠元素
主族元素
短周期元素
B.
硫酸
胶体
分散系
C.
电解质
化合物
纯净物
D.
置换反应
氧化还原反应
放热反应
难度: 简单查看答案及解析
-
吸进人体内的氧有2%转化为氧化性极强的活性氧,这些活性氧能加速人体衰老,被称为“生命杀手”,中国科学家尝试用Na2SeO3清除人体内的活性氧,则Na2SeO3的作用是( )
A. 还原剂 B. 氧化剂 C. 既是氧化剂又是还原剂 D. 以上均不是
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.医用酒精的浓度通常是95%
B.单质硅是将太阳能转化为电能的常用材料
C.淀粉、纤维素和油脂都属于天然高分子化合物
D.合成纤维和光导纤维都是新型无机非金属材料
难度: 简单查看答案及解析
-
下列关于有机物的说法正确的是( )
A.乙醇、乙酸、乙酸乙酯都能发生取代反应,且都有同分异构体
B.汽油、煤油、植物油均为含碳氢氧三种元素的化合物
C.纤维素和淀粉都能发生水解,但水解的最终产物不同
D.丁烷与戊烷分子内碳原子数相差一个,但同分异构体数却相差两个
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.乙烯和聚乙烯都可与溴水发生加成反应
B.酸性高锰酸钾溶液能鉴别苯、甲苯和四氯化碳
C.(NH4)2SO4、CuSO4、C2H5OH都能使蛋白质变性
D.葡萄糖、麦芽糖、蔗糖均能发生银镜反应
难度: 简单查看答案及解析
-
丙烯酸(CH2 = CH—COOH)的性质可能有:( )
① 加成反应 ② 水解反应 ③ 酯化反应 ④ 中和反应 ⑤ 氧化反应
A.只有①③ B.只有①③④ C.只有①③④⑤ D.①②③④⑤
难度: 简单查看答案及解析
-
最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子,其分子结构如图所示,已知断裂1molN—N吸收167kJ热量,生成1molN≡N放出942kJ热量,则下列说法正确的是( )
A.N4属于一种新型化合物 B.N4与N2互为同位素
C.N4沸点比P4(白磷)高 D.1molN4气体转变为N2将放出882kJ热量
难度: 简单查看答案及解析
-
下列反应中,属于取代反应的是( )
①CH3CH=CH2+Br2
CH3CHBrCH2Br
②CH3CH2OH
CH2=CH2↑+H2O
③CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O
④C6H6+HNO 3
C6H5NO2+H2O
A.①② B.③④ C.①③ D.②④
难度: 简单查看答案及解析
-
HNCO可用于消除汽车尾气中的NO和NO2,其反应原理为:HNCO + NOx → N2 + CO2 + H2O,下列说法正确的是( )
A.HNCO分子中存在非极性键 B.4.3g HNCO中含有0.1NA个原子
C.反应中NOx是还原剂 D.1 mol NO2在反应中转移4NA个电子
难度: 简单查看答案及解析
-
一定物质的量的Cl2与NaOH溶液反应,所得产物中含NaClO和NaClO3物质的量之比为3∶5,则参加反应的Cl2与NaOH物质的量之比为( )
A. 8∶11 B.3∶5 C.1∶2 D.18∶8
难度: 简单查看答案及解析
-
在指定环境中,下列各组离子一定可以大量共存的是( )
A.使pH试纸呈红色的溶液:
、
、
、
B.常温下,在
的溶液:
、
、
、
C.加入铝粉放出氢气的溶液:
、
、
、
D.使无色酚酞试液显红色的溶液:
、
、
、
难度: 简单查看答案及解析
-
在水溶液中,YO3n-和S2-发生如下反应:YO3n- + 3S2- +6H+ = Y- + 3S↓+ 3H2O,则YO3n-中Y元素的化合价和原子最外层电子数分别为( )
A.+4、6 B.+7、7 C.+5、7 D.+5、5
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是( )
A.NaHSO4溶液与Ba(OH)2溶液反应至中性: H++SO42—+Ba2++OH— = BaSO4↓+H2O
B.NaClO溶液与FeCl2溶液混合:Fe2+ + 2ClO- + 2H2O = Fe(OH)2↓ + 2HClO
C.NH4HSO3溶液与足量NaOH溶液反应:NH4+ + OH-= NH3↑ + H2O
D.将1mol/L NaAlO2溶液和1.5mol/L的HCl溶液等体积互相均匀混合:
6AlO2-+9H++3H2O=5Al(OH)3↓+Al3+
难度: 简单查看答案及解析
-
有一无色溶液,可能含有K+、Al3+、Mg2+、NH4+、Cl-、SO42-、HCO3-、MnO4-中的一种或几种。为确定其成分,进行如下实验:①取部分溶液,逐滴滴入NaOH溶液至过量,只观察到白色沉淀先增多后又部分溶解,无其它明显现象;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,无沉淀产生。下列推断正确的是( )
A.肯定有Al3+、Mg2+、Cl-,可能有K+
B.肯定有Al3+、Mg2+、Cl-,可能有NH4+
C.肯定有Al3+、Mg2+、HCO3-,肯定没有MnO4-
D.肯定有K+、Al3+、MnO4-,可能有HCO3-
难度: 简单查看答案及解析
-
已知常温下可用Co2O3制备Cl2,反应前后存在六种微粒:Co2O3﹑H2O﹑Cl2、H+ 、Cl-和Co2+ 。下列叙述不正确的是( )
A.氧化产物为Cl2
B.氧化剂与还原剂的物质的量之比为1∶2
C.若有3mol H2O生成,则反应中有2mol电子转移
D.当该反应生成2.24L Cl2时,则反应中有0.1mol电子转移
难度: 简单查看答案及解析
-
水热法制备纳米颗粒Y(化合物)的反应为:
3Fe2++2S2O2-3+O2+aOH-==Y+S4O2-6+2H2O下列说法中,不正确的是( )
A.S2O2-3是还原剂
B.Y的化学式为Fe2O3
C.a =4
D.每有1molO2参加反应,转移的电子总数为4mol
难度: 简单查看答案及解析
-
继科学家发现C3O2是金星大气成分之后,2004年,美国科学家通过“勇气”号太空车探测出水星大气中含有一种称为硫化羰(化学式为COS)的物质。已知硫化羰与二氧化碳的结构相似,但在氧气中会燃烧,下列有关C3O2与硫化羰的说法中正确的是( )
A.C3O2可以在氧气中完全燃烧生成CO2
B.C3O2和CO2都是碳的氧化物,它们互为同分异构体
C.COS是由极性键构成的非极性分子,分子中所有原子都满足8电子稳定结构
D.COS在氧气中完全燃烧后,生成物是CO2和SO3
难度: 简单查看答案及解析
-
短周期元素W、X、Y和Z的原子序数依次增大。其中W的阴离子的核外电子数与X、Y、Z原子的核外内层电子数相同。X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质,而Z不能形成双原子分子。根据以上叙述,下列说法中正确的是( )
A.以上四种元素的原子半径大小为W<X<Y<Z
B.W、X、Y、Z原子的核外最外层电子数的总和为20
C.W与Y可形成既含极性共价键又含非极性共价键的化合物
D.由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点
难度: 简单查看答案及解析