-
气体摩尔体积的单位是( )
A.L B.mol C.L·mol-1 D.mol·L-1
难度: 简单查看答案及解析
-
下列各组物质按化合物、混合物顺序排列的是( )
A..空气、CuSO4·5H2O B.生石灰、液态氧
C.干冰、冰水 D.Fe3O4、氨水
难度: 简单查看答案及解析
-
下列事实与胶体性质无关的是( )
A.豆浆里加入盐卤制豆腐 B.冶金厂常用高压直流电除去大量烟尘
C.血液透沂 D.将植物油倒入水中搅拌,静置、分层
难度: 简单查看答案及解析
-
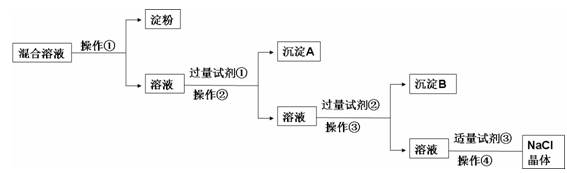
难度: 简单查看答案及解析
-
下列实验操作或设计中,可行的是( )
A. CO2通入足量BaCl2溶液中,产生白色沉淀
B. 除去O2中混有的H2,可将气体通过灼热CuO
C. 利用分液斗可分离酒精和氯化钠的混合物
D. 加稀盐酸后过滤,除去铜扮中没有的少量镁粉和铝粉
难度: 简单查看答案及解析
-
根据下列实验事实得出的相应结论正确的是( )
序号
实验事实
结论
A
气体A的水溶液可以导电
A不一定是电解质
B
向某溶液中加入BaCl2溶液和稀HNO3,有白色沉淀生成
原溶液中含SO42-
C
向某溶液中滴加CCl4,振荡、静置,下层溶液呈紫红色
原溶液中一定有I-
D
某钠盐加入盐酸,若有气体生成
该盐一定是碳酸钠
难度: 简单查看答案及解析
-
下列化学反应的离子方程式书写正确的是( )
A.浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑
B.金属铜投入硝酸银溶液中:Cu+Ag+=Cu2++Ag
C氢氧化铜固体投入稀硝酸:Cu(OH)2+2H+=Cu2++2H2O
D.石灰石溶于醋酸:CaCO3+2H+=Ca2++H2O+CO2↑
难度: 简单查看答案及解析
-
下图中白球代表氢原子.黑球代表氦原子,方框代表容器(有一个可左右滑动的隔板,忽略隔板质量和摩擦力)。其中能表示在相同条件下,等质量的氢气与氦气示意图是(He—4 ) ( )
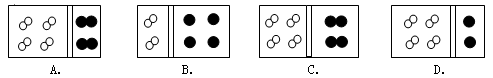
难度: 简单查看答案及解析
-
下列关于物质的量浓度表达正确的是( )
A.10℃时,100mL0.35mol/L的KCl饱和溶液蒸发5g水,冷却到10℃,其体积小于100mL,它的物质的量浓度仍为0.35mol/L
B.1L水吸收22.4 LHCl时所得盐酸的浓度是1mol/L
C.在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相同
D.Na2SO4溶液中Na+和SO42-的物质的量浓度之比为l : 2
难度: 简单查看答案及解析
-
铝与稀硝酸发生反应的化学方程式为;Al+HNO3=Al(NO3)3+NO↑+H2O,若配平方程式后,HNO3的计量系数应该是( )
A .2 B .4 C .6 D.8
难度: 简单查看答案及解析
-
配制物质的量浓度溶液时,其它操作都正确,下列操作对所得溶液浓度有偏高影响的是( )
A. 称量时砖码生锈 B. 溶解前烧杯内有水
C. 容量瓶洗涤后未干澡 D. 定容时仰视容量瓶刻度线
难度: 中等查看答案及解析
-
下列各组离子能在呈酸性的无色溶滚中大量共存的是( )
A.Ba2+、Na+、NO3-、SO42- B.Mg2+、Cl-、Al3+、SO42-
C .K+\、OH-、HCO3-、NO3- D.NH4+、Na+、Fe2+、MnO4-
难度: 中等查看答案及解析
-
下列溶液中有关的化学方程式,正确的是( )
A.NaHCO3的电离方程式:NaHCO3=Na++H++CO32-
B.Na投入硫酸铜溶液反应的化学方程式:2Na+CuSO4=Cu+Na2SO4
C.Ca(HCO3)2与澄清石灰水反应的离子方程式:HCO3-+Ca2++OH-=CaCO3↓+H2O
D.Ba(OH)2的电离方程式:Ba(OH)2=Ba2++(OH)2-
难度: 中等查看答案及解析
-
10月11日早上7点30分,神舟十一号飞船发射成功。其运载火箭点火后,偏二甲肼与四氧化二氮发生剧烈反应:(CH3) 2NH2+2N2O4=2CO2+4H2O+3N2,下述正确的说法是( )
A.该反应既是分解反应又是离子反应 B.N2O4被还原
C .(CH3) 2NH2中碳元索为+4 价 D.H2O是还原产物
难度: 中等查看答案及解析
-
工业制取ClO2:2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4。下列说法正确的是( )
A.1mol氧化剂在反应中得到1mol电子 B.SO2在反应中被还原
C.H2SO4在反应中作氧化剂 D.NaClO3在反应中失去电子
难度: 中等查看答案及解析
-
有下列三个反应①3Cl2+2FeI2=2FeCl3+2I2②2Fe2++Br2=2Fe3++2Br-③2Fe3++2I-=2Fe2++I2,下列说法正确的是( )
A.①中氧化产物和还原产物的质量之比为1:1
B.根据以上方程式可以得到氧化性强弱顺序:Cl2>Fe3+>Br2>Fe2+
C.根据以上方程式一定可推知:Br2+2I-=2Br-+I2
D.根据反应①②一定可以推理得到Cl2+FeBr2=FeCl2+Br2
难度: 困难查看答案及解析
-
FeCl3溶液和Fe(OH)3胶体共同具备的性质是( )
A.加入饱和NaCl溶液都产生沉淀 B.加入盐酸先产生沉淀,然后沉淀溶解
C.都能产生丁达尔效应 D.分散质的粒子都能通过滤纸
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.只含一种元素的物质一定是单质 B.只含一种分子的物质一定是纯净物
C.非金属氧化物一定是酸性氧化物 D.有单质生成的反应一定是置换反应
难度: 中等查看答案及解析
-
下列实验操作能达到实验目的的是(Cu-64 O-16 H-1 S-32) ( )
实验目的
实验操作
A
配制1.0mol/LCuSO4溶液
把25g胆矾晶体溶于水配成100mL溶液
B
检验CaO中是否含有Ca(OH)2
可将其加水后滴加酚酞溶液
C
实验制取大量CO2
向稀硫酸中加入大理石
D
配制Fe(OH)3胶体
将饱和的FeCl3溶液滴加到热NaOH溶液中
难度: 中等查看答案及解析
-
NA表示阿伏伽德罗常数,下列说法正确的是( )
A.16g氧气和臭氧(O3)的混合物中含有的氧原子数为NA
B.同温同压下,相同体积的任何气体都含有NA个分子
C.NA个空气分子的体积均为22.4L
D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有的Cl-个数为NA
难度: 困难查看答案及解析