-
化学与生产、生活密切相关,下列说法正确的是
A.焰火的五彩缤纷是某些金属元素化学性质的展现
B.将煤气化后再作为能源,可减少PM2.5引起的危害
C.石英用于生产光导纤维和计算机芯片
D.包装食品里常有硅胶、石灰、还原铁粉三类小包,其作用相同
难度: 简单查看答案及解析
-
下列各组物质或概念之间,不符合右图所示关系的是
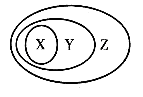
X
Y
Z
A
硫酸
含氧酸
酸
B
胶体
分散系
混合物
C
电解质
化合物
纯净物
D
置换反应
氧化还原反应
离子反应
难度: 中等查看答案及解析
-
下列装置、试剂选用或操作正确的是
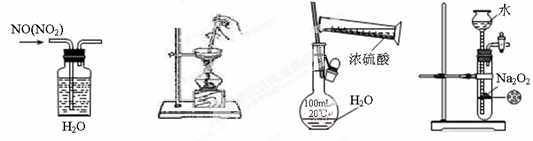
A.除去NO中的NO2 B.用于AlCl3蒸发结晶 C.稀释浓硫酸 D.制备少量O2
难度: 中等查看答案及解析
-
以下除杂方案不正确的是
A. Cl2中混有HCl,可依次通入盛有饱和食盐水、浓H2SO4的洗气瓶
B. NH4Cl 溶液中混有Fe3+,可加入NaOH溶液后过滤
C. CO中混有CO2,可依次通入盛NaOH 溶液、浓 H2SO4的洗气瓶
D. Na2CO3固体中混有NaHCO3,可用加热的方法除尽
难度: 中等查看答案及解析
-
下列实验设计能完成预期实验目的的是
选项
实验目的
实验设计
A
配制10%的ZnSO4溶液
将10gZnSO4·7H2O溶解于90g水中
B
配制100mL、浓度约为1mol/L的氯化钠溶液
用托盘天平称量5.85g氯化钠固体,转移至烧杯,加入100mL蒸馏水,搅拌溶液
C
验证二氧化硫的漂白性
将二氧化硫通入品红溶液,溶液褪色
D
取出分液漏斗中所需的上层液体
下层液体从分液漏斗下端管口放出,关闭活塞,换一个接受容器,上层液体继续从分液漏斗下端放出
难度: 中等查看答案及解析
-
下列选项中有关离子方程式的书写正确的是
A.过氧化钠固体与水反应:2O22-+2H2O=4OH-+O2↑
B.H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O
C.过量的CO2通入Ca(ClO)2溶液中:ClO-+CO2+H2O=HCO3-+HClO
D.硫化钠水溶液呈碱性的原因:S2-+2H2O=H2S+2OH-
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列各项叙述正确的是
①1 molCl2参加反应转移电子数一定为2NA
②1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA
③标准状况下,44.8 L NO与22.4 LO2混合后气体中分子总数为2NA
④1L 2mol·L-1的Al(NO3)3溶液中含Al3+个数为2NA
⑤1 L 2 mol/L的氯化铁溶液完全制成胶体,氢氧化铁胶体的粒子数小于2 NA
⑥6.0 g SiO2晶体中含有的硅氧键数目为0.4 NA
⑦1 molCH5+所含的电子数为10NA
⑧在标准状况下,2.8 g N2和2.8 g CO所含电子数均为1.4 NA
⑨300 mL 2 mol/L蔗糖溶液中所含分子数为0.6 NA
⑩标准状况下,2.24 L乙醇分子所含的C-H键数为 0.5NA
A.②③⑦⑧⑨⑩ B.①②③⑤⑧⑨ C.②⑤⑥⑦⑧ D.②④⑦⑧⑩
难度: 困难查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
①0.1 mol·L-1NaAlO2溶液:H+、Na+、Cl-、SO42-
②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-、S2-、SO32-
③水电离的H+浓度为10-12mol·L-1的溶液中:Cl-、CO32-、NO3-、SO32-
④加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、K+、SO42-、NO3-
⑤使甲基橙变黄的溶液中:Fe2+、MnO4-、NO3-、Na+、SO42-
⑥中性溶液中:Fe3+、Al3+、NO3-、Cl-、S2-
A.①③⑤ B.② C.②④⑥ D.④⑤
难度: 困难查看答案及解析
-
在100mL HNO3和H2SO4的混合溶液中,两种酸的物质的量浓度之和为0.6mol/L.向该溶液中加入足量的铜粉,加热,充分反应后,所得溶液中Cu2+的物质的量浓度最大值为(反应前后溶液体积变化忽略不计)
A.0.225mol/L B.0.30mol/L C.0.36mol/L D.0.45mol/L
难度: 中等查看答案及解析
-
已知下表数据:
物质
Fe(OH)2
Cu(OH)2
Fe(OH)3
Ksp(25°C)
8.0×10-16
2.2×10-20
4.0×10-38
完全沉淀时PH范围
≥9.6
≥6.4
≥3.4
对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法,不正确的是
A.向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
B.该溶液中c(SO42-):[c(Cu2+)+c(Fe2+)+c(Fe3+)]> 5:4
C.向该溶液中加入适量氯水,并调节pH到3—4后过滤,可获得纯净的CuSO4溶液
D.在pH=5的溶液中Fe3+不能大量存在
难度: 中等查看答案及解析
-
A~D是含同一元素的四种物质,相互之间有如图所示的转化关系,其中D是最高价氧化物对应的水化物。那么A可能是
①N2 ②Si ③Cu ④CH4 ⑤H2S
A.只有①④⑤ B.只有①②③ C.只有①⑤ D.全部
难度: 中等查看答案及解析
-
可逆反应2SO2(g)+O2(g)
2SO3(g) ;△H<0, 在一定条件下达到平衡状态,时间为t1时改变条件。化学反应速率与反应时间的关系如图所示。
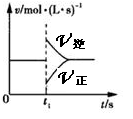
下列说法正确的是
A.维持温度、反应体系容积不变,t1时充入SO3(g)
B.维持压强不变,t1时升高反应体系温度
C.维持温度、容积不变,t1时充入一定量Ar
D.维持温度、压强不变,t1时充入SO3(g)
难度: 中等查看答案及解析
-
二氧化硅广泛存在于自然界中,在日常生活、生产、科研及新型材料等方面有着重要的用途。a~e是对①~⑤反应中SiO2所表现的化学性质或作用进行判断,a~e的叙述中有几个正确的选项
①SiO2+2NaOH=Na2SiO3+H2O ②SiO2+2C
Si+2CO↑
③SiO2+4HF=SiF4↑+2H2O ④Na2CO3+SiO2
Na2SiO3+CO2↑
⑤SiO2+3C
SiC+2CO↑
a.反应①中SiO2作为玻璃的成分被消耗,用于刻蚀玻璃
b.反应②中SiO2表现出氧化性
c.反应③中SiO2表现了酸性氧化物的通性
d.反应④符合用较强酸制取较弱酸的道理
e.反应⑤中SiO2未参加氧化还原反应
A.二个 B.三个 C.四个 D.五个
难度: 中等查看答案及解析
-
元素X、Y、Z、W的原子序数依次增大,且原子序数之和为22,最外层电子数之和为16,在化合物Y2X2、Z2X4、X2W2中,相应分子内各原子最外层电子都满足相应稳定结构。下列说法正确的是
A.X、Y、Z、W的原子半径的大小关系为:W> Y >Z> X
B.在化合物Y2X2、Z2X4、X2W2中,分子所含的共用电子对数相等
C.与元素Y、Z相比,元素W形成的简单氢化物最稳定,是因为其分子间存在氢键
D.X、Y、Z、W四种元素可形成化学式为Y2X7ZW2的化合物
难度: 简单查看答案及解析
-
在1200℃时,天然气脱硫工艺中会发生下列反应
①H2S(g)+
O2(g) = SO2(g)+H2O(g) △H 1
②2H2S(g)+SO2(g) =
S2(g)+2H2O(g) △H 2
③H2S(g)+
O2(g) = S(g)+H2O(g) △H 3
④S(g) =
S2(g) △H4
则△H 4的正确表达式为
A.△H 4 =
(3△H 3 - △H 1 - △H 2)
B. △H 4 =
(△H 1 + △H 2 - 3△H 3)
C.△H 4 =
(△H 1 + △H 2 - 3△H 3)
D.△H 4 =
(△H 1 - △H 2 - 3△H 3)
难度: 简单查看答案及解析
-
某强酸性溶液中可能存在Al3+、Fe2+、NH4+、Ba2+、Cl﹣、CO32﹣、SO42﹣、NO3﹣中的若干种,现取适量溶液进行如下实验
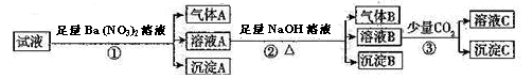
下列有关判断正确的是
A.原溶液中一定有Fe2+、SO42﹣、H+、NH4+、Al3+
B.原溶液中一定没有Ba2+、CO32﹣、NO3﹣
C.步骤③中反应的离子方程式为2AlO2﹣+CO2+3H2O=2Al(OH)3↓+CO32﹣
D.气体A、B之间肯定不能发生反应
难度: 困难查看答案及解析
-
装置(Ⅰ)为铁镍(Fe-Ni)可充电电池:Fe+NiO2+2H2O
Fe(OH)2+Ni(OH)2;
装置(Ⅱ)为电解示意图。当闭合开关K时,Y附近溶液先变红。下列说法正确的是

A.闭合K时,X的电极反应式为:2H++2e-= H2↑
B.闭合K时,A电极反应式为:NiO2+2e-+2H+= Ni(OH)2
C.给装置(Ⅰ)充电时,B极参与反应的物质被氧化
D.给装置(Ⅰ)充电时,OH- 通过阴离子交换膜,
移向A电极
难度: 困难查看答案及解析
-
化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的特殊情况。下列反应中,属干这种情况的是
①过量锌与18 mol/L的硫酸反应;②过量氢气与少量氮气在催化剂存在下充分反应;
③浓盐酸与过量的MnO2反应;④过量铜与浓硫酸反应;⑤过量铜与稀硝酸反应;
⑥过量稀硫酸与大块状石灰石反应。⑦常温下过量的浓硫酸与铝反应
A. ②③⑤ B.②③④⑥⑦ C.①④⑤ D.①②③④⑤
难度: 中等查看答案及解析
-
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量的铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中逐滴加入5mol/L NaOH溶液,所加的NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示,下列说法不正确的是
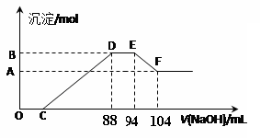
A.稀硝酸与铝粉、铁粉反应,其还原产物为硝酸铵
B.图中C点对应溶液体积为48mL
C.原硝酸溶液中含硝酸的物质的量为0.5mol
D.样品中铝粉和铁粉的物质的量之比5:3
难度: 困难查看答案及解析
