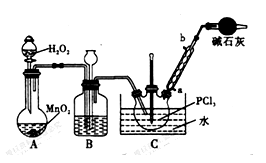
-
下列说法不正确的是
A. pH计不能用于酸碱中和滴定终点的判断
B. 利用太阳能等淸洁能源代替化石燃料,有利于节约资源、保护环境
C. 糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同
D. 葡萄中的花靑素在碱性环境下显蓝色,故可用苏打粉检验假红酒
难度: 中等查看答案及解析
-
下列说法正确的是
A. 在实验室中,从海带中提取单质碘的方法:取样→灼烧→溶解→过滤→萃取
B. 用乙醇和浓H2SO4制备乙烯时,可用水浴加热控制反应的温度
C. 向FeBr2溶液中加入少量氯水,再加CCl4萃取,CCl4层无色,水层变为棕黄色,说明Fe2+的还原性强于Br-
D. 室温下,向苯和苯酚的混合溶液中加入浓溴水,充分反应后过滤,以除去苯中少量的苯酚
难度: 中等查看答案及解析
-
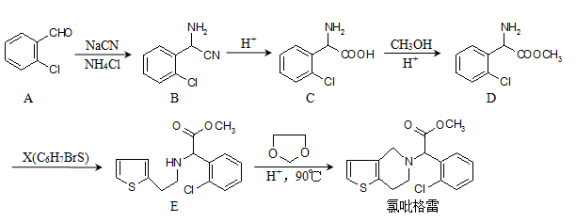
有机物a和苯通过反应合成b的过程可表示为下图(无机小分子产物略去)。下列说法正确的是
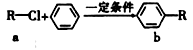
A. 该反应是加成反应
B. 若R为CH3时,b中所有原子可能共面
C. 若R为C4H9时,取代b苯环上的氢的一氯代物的可能的结构共有12种
D. 若R为C4H5O时,lmol b最多可以与6mol H2加成
难度: 困难查看答案及解析
-
X、Y、Z是短周期元素,原子半径的大小:r(Y)>r(X)>r(Z),三种元素的原子序数之和为15;X、Y、Z三种元素的常见单质在适当条件下可发生如下图所示转化关系,其中R为10电子分子,是一种常见的无机溶剂。下列说法不正确的是
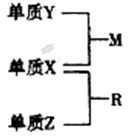
A. X元素位于周期表中的第16列
B. X的氢化物沸点一定高于Y的氢化物的沸点
C. X、Y、Z元素可以组成一种分子式为Z2Y2X4的化合物,其水溶液中水的电离受到了抑制
D. X、Y、Z元素两两之间均能形成原子个数比为1 : 1的化合物
难度: 中等查看答案及解析
-
用一种阴、阳离子双隔膜三室电解槽处理废水中的NH4+,模拟装置如下图所示。下列说法不正确的是

A. 阳极室溶液由无色变成浅绿色
B. 当电路中通过lmol电子的电量时,阴极有0.5mol的气体生成
C. 电解时中间室(NH4)2SO4溶液浓度下降
D. 电解一段时间后,阴极室溶液中的溶质一定是(NH4)3PO4
难度: 中等查看答案及解析
-
常温下,向l0mL0.1mol/L的HR溶液中逐渐滴入0.lmol/L的NH3·H2O 溶液,所得溶液pH及导电性变化如图。下列分析不正确的是
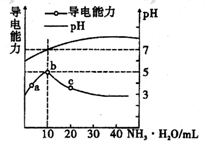
A. a〜b点导电能力增强,说明HR为弱酸
B. b点溶液,c(NH3•H2O)=c(R-)+c(H+)-c(OH-)
C. c点溶液,存在c(NH4+)>c(R-)>c(OH-)>c(H+)
D. 常温下,HR和NH3•H2O的电离平衡常数相等
难度: 困难查看答案及解析
-
已知:还原性HSO3->I-,氧化性IO3->I2。在含3mol NaHSO3的溶液中逐滴加人KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如图所示。下列说法不正确的是

A. 0-a段发生反应:3HSO3-+IO3-=3SO42-+I-+3H+
B. a~b段共消耗NaHSO3的物质的量为1.8mol
C. b~c段反应:氧化产物为I2
D. 当溶液中I-与I2的物质的量之比为5 : 1时,加入的KIO3为1.lmol
难度: 困难查看答案及解析