-
下列是某学生自己总结的一些规律,其中正确的是
A.氧化物不可能是还原产物,只可能是氧化产物
B.有些化学反应不属于化合、分解、置换、复分解中的任何一种反应
C.一种元素可能有多种氧化物,但同种化合价只对应一种氧化物
D.将Mg(HCO3)2溶液加热,最终得到Mg(OH)2沉淀,由此可知溶解度Mg(OH)2> Mg(HCO3)2
难度: 中等查看答案及解析
-
设阿伏加德罗常数为NA,下列说法正确的是
A.1mol Cl2与足量Fe反应,转移的电子数为3NA
B.20g重水(D2O)中含有的中子数为8 NA
C.常温常压下,46g的NO2和N2O4混合气体含有的原子数为3NA
D.标准状况下,22.4L已烷中共价键数目为19NA
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.碳酸氢钾水【解析】
HCO3—+H2OH3O++CO32—
B.向硝酸银溶液中加入过量氨水:Ag++NH3·H2O=AgOH↓+NH4+
C.浓度均为0.1mol·L-1的氢氧化钡溶液与碳酸氢铵溶液等体积混合Ba2++2OH-+NH4++ HCO3—=BaCO3↓+NH3·H2O+H2O
D.向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O=HClO+HSO3-
难度: 中等查看答案及解析
-
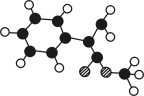
据测定,指示剂酚酞的结构简式可表示为下图:,下列说法不正确的是

A.酚酞的分子式为C20H14O4
B.酚酞可与FeCl3溶液发生显色反应
C.1 mol酚酞与H2完全加成,最多可消耗10 mol H2
D.1 mol酚酞与NaOH溶液共热,最多可消耗3 mol NaOH
难度: 中等查看答案及解析
-
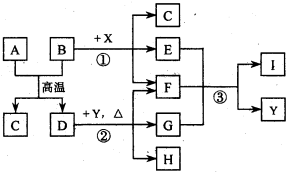
可逆反应aA(s) + bB(g)
cC(g) + dD(g) ; △H==Q KJ/mol.当其他条件不变时,反应过程中某物质在混合物中的百分含量与温度(T)、压强(p)的关系如图所示,以下判断正确的是
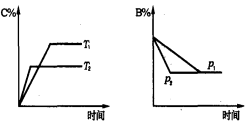
A.T1<T2,Q>0
B.Pl<P2,b==c+d
C.Tl>T2,Q<0
D.P1<P2,a+b==c+d
难度: 中等查看答案及解析
-
根据下列实验内容得出的结论正确的是
选项
实验内容
结论
A
某物质的水溶液使红色石蕊试纸变蓝
该物质一定是碱
B
某气体能使湿润淀粉碘化钾试纸变蓝
该气体一定是氯气
C
某物质的水溶液中加入盐酸产生无色无味气体
该溶液一定含有碳酸根离子
D
0.84g铁和50.00mL 1.00mol/L的稀硝酸反应
反应后溶液中一定有Fe3+和Fe2+
难度: 中等查看答案及解析
-
下列说法正确的是
A.t℃时,某溶液的pH=6,则该溶液一定为酸性
B.常温下,将pH=11的氨水稀释后,溶液中所有离子的浓度均降低
C.常温下,将pH=11的NaOH溶液和pH=3的CH3COOH溶液等体积混合后,溶液的pH<7
D.常温下,物质的量浓度和体积相同的K2CO3、K2SO4、HC1溶液混合后,溶液的pH<7
难度: 中等查看答案及解析