-
下列金属中,表面自然形成的氧化层能保护内层金属不被空气氧化的是( )
A.K B.Na C.Fe D.Al
难度: 简单查看答案及解析
-
下列实验操作过程中,最后没有沉淀且溶液呈无色透明的是( )
A.NO2不断通人FeSO4溶液中 B.CO2不断通人CaCl2溶液中
C.NH3不断通人AlCl3溶液中 D.SO2通人已酸化的Ba(NO3)2溶液中
难度: 中等查看答案及解析
-
下列几种类推结论中正确的是
A. 酸的水溶液呈酸性,故酸性水溶液一定是酸的水溶液
B. Fe3O4可写成FeO・Fe2O3;Pb3O4也可写成PbO・Pb2O3
C. 工业上通过电解熔融MgCl2来制取金属镁;也可以通过电解熔融AlCl3来制取金属铝
D. 第2周期元素氢化物稳定性顺序是HF>H2O>NH3;则第3周期元素氢化物稳定性顺序是HCl>H2S>PH3
难度: 困难查看答案及解析
-
下列说法中不正确的是
A. 光导纤维的主要成分是SiO2
B. 玻璃和陶瓷都属于传统硅酸盐材料
C. 明矾和漂白粉均可用于自来水的杀菌、消毒
D. 大量排放SO2会引起酸雨
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
A. 质子数为53、中子数为78的碘原子:
B. S2-的结构示意图:
C. N2的电子式:
D. NH4I的电子式:
难度: 简单查看答案及解析
-
根据中学对电解质、非电解质的定义判断,下列叙述
正确的是
A. 虽然石墨有较好的导电性,但它属于非电解质
B. 实验测得NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质
C. 实验测得液态HCl、固体NaCl均不能导电,所以HCl、NaCl均是非电解质
D. 蔗糖(纯净物)在水溶液和熔融状态下均不能导电,所以蔗糖属于非电解质
难度: 简单查看答案及解析
-
钚是一种具有放射性的超铀元素,几位美国科学家在1940年首次发现这一元素,它目前被应用于核武器和核反应堆。下列说法正确的是
A.
、
、
是钚的三种同素异形体
B.
中有94个中子
C.
的中子数与质子数之差为51
D. 一个
的质量为240 g
难度: 简单查看答案及解析
-
向盛有Cl2的三个集气瓶甲、乙、丙中各注入下列液体中的一种,经过振荡,现象如下图所示,则甲、乙、丙中注入的液体分别是
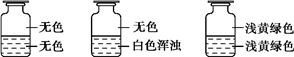
甲 乙 丙
①AgNO3溶液 ②NaOH溶液 ③水
A. ②①③ B. ①②③ C. ③②① D. ①③②
难度: 简单查看答案及解析
-
下列有关物质的性质与其应用不对应的是
A. MgO、Al2O3的熔点很高,可制作耐高温材料
B. NaHCO3能与碱反应,食品工业上用作焙制糕点的膨松剂
C. Al具有良好的延展性和抗腐蚀性,可制成铝箔包装物品
D. 利用钠蒸气放电发光的性质制造的高压钠灯,可发出射程远、透雾能力强的黄光
难度: 中等查看答案及解析
-
下列有关说法正确的是
A. 在酒精灯加热条件下,Na2CO3、NaHCO3固体都能发生分解
B. Fe(OH)3胶体无色、透明,能产生丁达尔现象
C. H2、SO2、CO2三种气体都可用浓H2SO4干燥
D. SiO2既能和NaOH溶液反应又能和氢氟酸反应,所以是两性氧化物
难度: 中等查看答案及解析
-
在CO2中,Mg燃烧生成MgO和C。下列说法正确的是
A. 元素C的单质只存在金刚石和石墨两种同素异形体
B. Mg、MgO中镁元素微粒的半径:r(Mg2+)>r(Mg)
C. 在该反应条件下,Mg的还原性强于C的还原性
D. 该反应属于非氧化还原反应
难度: 中等查看答案及解析
-
下图是周期表中短周期的一部分,若a原子最外层的电子数比次外层少了3个,则下列说法不正确的是
A. d的氢化物比b的氢化物稳定
B. d与c不能形成化合物
C. a、b、c的最高价氧化物对应水化物的酸性强弱的关系是c>b>a
D. 原子半径的大小顺序是a>b>c>d
难度: 中等查看答案及解析
-
下列反应中,改变反应物的用量或浓度,不会改变生成物的是
A. 铜和硝酸反应 B. 二氧化碳通入氢氧化钠溶液中
C. 铁和硝酸的反应 D. 氯化铝与氨水的反应
难度: 中等查看答案及解析
-
下列试剂不会因为空气中的氧气而变质的是
A. 过氧化钠 B. 氢硫酸 C. 硫酸亚铁 D. 一氧化氮
难度: 中等查看答案及解析
-
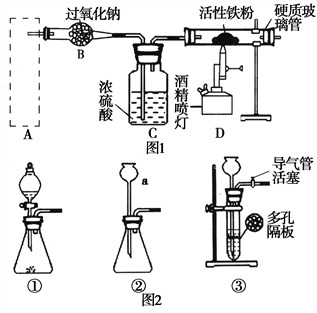
实验室制备Cl2通常采用下列反应: MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O。据此从如图所示装置中选择制备并收集干燥、纯净Cl2的装置是
A.
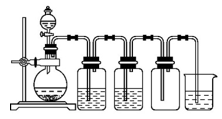 B.
B. 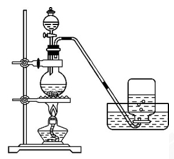
C.
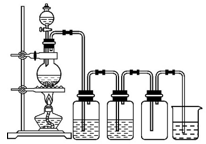 D.
D. 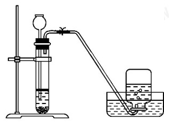
难度: 中等查看答案及解析
-
下述实验不能达到预期目的的是
选项
实验内容
实验目的
A
将铜片分别与浓、稀硝酸反应
探究浓、稀硝酸氧化性的相对强弱
B
将SO2通入酸性KMnO4溶液中
证明SO2具有漂白性
C
将Cl2通入NaBr溶液中,然后加入CCl4,振荡、静置
比较氯气与溴的氧化性强弱
D
向盛有20 g蔗糖的烧杯中加入几滴水,搅拌均匀;再加入少许浓硫酸,迅速搅拌
探究浓硫酸的脱水性
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
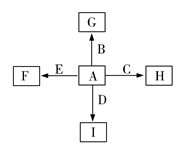
已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系如图所示。
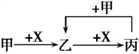
则甲和X不可能是
A. 甲为C,X为O2
B. 甲为SO2,X为NaOH溶液
C. 甲为Fe,X为Cl2
D. 甲为硝酸溶液,X为Fe
难度: 困难查看答案及解析
-
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是
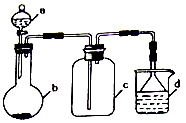
选项
a中物质
b中物质
c收集的气体
d中物质
A
稀硫酸
锌片
H2
H2O
B
浓硫酸
Na2SO3
SO2
NaOH溶液
C
稀硝酸
Cu
NO2
H2O
D
浓盐酸
MnO2
Cl2
NaOH溶液
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
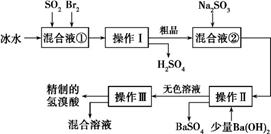
某学生设计了如图所示的方法对A盐进行鉴定:
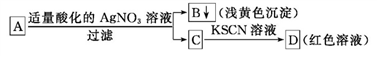
由此分析,下列结论中,正确的是
A. A中可能有Fe3+ B. B为AgI沉淀
C. C中可能有Fe3+ D. A一定为FeBr2溶液
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A. 0.1 mol·L-1NaCl溶液中Na+的数目为0.1NA
B. 标准状况下,11.2 L H2O中含有分子的数目为0.5NA
C. 常温常压下,14 g由N2与CO组成的混合气体含有的原子数目为NA
D. 1 mol Na被完全氧化生成Na2O2,失去的电子数为2NA
难度: 中等查看答案及解析
-
下列解释事实的离子方程式正确的是
A. 向盛有Ba(OH)2和酚酞的溶液中滴加硫酸,有白色沉淀生成,溶液由红色变为无色:Ba2++OH-+H++SO42-=== BaSO4↓+H2O
B. 向稀HNO3中滴加Na2SO3溶液有气体生成:SO32-+2H+ ==== SO2↑+H2O
C. 向硫酸铝溶液中加入氨水出现白色胶状沉淀: Al3++3OH- === Al(OH)3↓
D. 实验室不用配磨口玻璃塞的试剂瓶盛装氢氧化钠溶液:SiO2+2OH-=SiO32-+H2O
难度: 困难查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 0.1 mol·L—1的NaOH溶液:K+、Na+、SO42—、CO32—
B. 0.1 mol·L—1的Na2CO3溶液:K+、Ba2+、NO3—、Cl—
C. 0.1 mol·L—1FeCl3溶液:K+、NH4+、I—、SCN—
D. 1.0mol▪L—1的KNO3溶液:H+、Fe2+、Cl—、SO42—
难度: 中等查看答案及解析
-
W是由短周期元素X、Y、Z组成的盐。X、Y、Z原子的最外层电子数依次增大,Z原子最外层电子数是内层电子数的3倍;X、Y原子最外层电子数之和等于Z原子的最外层电子数;Y、Z同周期且相邻,但与X不同周期。下列说法一定正确的是
A. 三种元素的最高正化合价中,Z的最大
B. W晶体中只存在有共价键
C. 原子半径:X>Y>Z
D. Y的最高价氧化物对应的水化物是强酸
难度: 中等查看答案及解析
-
下列物质的转化在给定条件下能实现的是
①
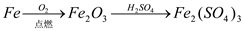
②
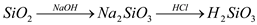
③
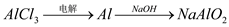
④
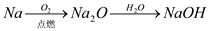
⑤

⑥
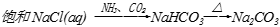
A. ①②⑤ B. ②③⑥ C. ②⑤⑥ D. ①③④
难度: 中等查看答案及解析