-
为了建设资源节约型、环境友好型社会,节能减排将成为我国政府目前工作的重点,以下措施中不能体现这一思想的是
A.在电解铝工业中添加冰晶石
B.研制出性能优良的催化剂,降低反应所需温度
C.开发太阳能、风能、氢能等清洁能源
D.大力发展火电,缓解用电紧张
难度: 困难查看答案及解析
-
下列关于化学反应方向的叙述中正确的是
A.ΔH<0,ΔS>0的反应肯定是自发的 B.ΔH<0,ΔS<0的反应肯定是自发的
C.ΔH>0,ΔS>0的反应肯定是自发的 D.ΔH>0,ΔS<0的反应肯定是自发的
难度: 困难查看答案及解析
-
在电解水制取H2和O2时,为了增强溶液的导电性,常加入一些电解质。下列物质中最合适的是
A.Na2SO4 B.CuC12 C.NaCl D.AgNO3
难度: 困难查看答案及解析
-
在2A(g)+B(g)
3C(g)+4D(g)反应中,表示该反应速率最大的是
A.υ(A)= 0.5 mol · L-1·s-1 B.υ(B)= 0.3 mol · L-1·s-1
C.υ(C)= 0.8 mol · L-1·s-1 D.υ(D)= 1 mol · L-1·s-1
难度: 困难查看答案及解析
-
下列事实中,与电化学腐蚀无关的是
A.用于连接铜板的铁螺丝容易生锈 B.为保护海轮的船壳,常在船壳上镶入锌块
C.生铁比纯铁容易生锈 D.在铁中加入铬等特殊金属形成不锈钢
难度: 困难查看答案及解析
-
下列物质分离方法不正确的是
A.分离铁屑与水的混合物——倾析法
B.分离铜离子和铁离子的混合物——纸层析法
C.分离溴和水的混合物——分液法
D.分离硝酸钾和氯化钠的混合物——结晶法
难度: 困难查看答案及解析
-
下列说法错误的是
A.用硝酸银溶液鉴别NaNO2和NaCl
B.用新制Cu(OH)2检验牙膏中的甘油
C.用滴有氢氧化钠的酚酞溶液可以鉴别乙醇水溶液和苯酚水溶液
D.用KSCN溶液检验制得的硫酸亚铁铵晶体是否变质
难度: 困难查看答案及解析
-
已知氯化银在水中存在沉淀溶解平衡:AgCl
Ag+ + Cl- ,25℃时氯化银的KSP=1.8×10-10。现将足量的氯化银分别放入下列选项的溶液中,充分搅拌后,相同温度下,银离子浓度最小的是
A.100mL蒸馏水中 B.50mL0.1mol•L-1的氯化镁溶液
C.100mL0.1mol•L-1的氯化钠溶液 D.50mL0.1mol•L-1的氯化铝溶液
难度: 困难查看答案及解析
-
某温度下,满足下列条件的溶液肯定呈酸性的是
A.加酚酞显无色的溶液 B.含有H+的溶液
C.pH<7的溶液 D.c(H+)>c(OH―)的溶液
难度: 困难查看答案及解析
-
常温下在水中加入下列物质,不会破坏水的电离平衡的是
A.通入HCl气体 B.加入苯酚钠固体 C.加入蔗糖 D.加入金属钠
难度: 困难查看答案及解析
-
下列仪器使用方法错误的是
A.分液漏斗使用前需检查是否漏液
B.减压过滤实验结束后,应先拆下连接抽气泵和吸滤瓶的橡皮管,然后关闭水龙头
C.坩埚可直接加热,不需要垫石棉网
D.蒸馏时温度计水银球应该插入液面以下
难度: 困难查看答案及解析
-
下列说法不正确的是
A.增大压强,活化分子百分数不变,化学反应速率增大
B.升高温度,活化分子百分数增大,化学反应速率增大
C.增大反应物浓度,活化分子百分数增大,化学反应速率增大
D.使用催化剂,活化分子百分数增大,化学反应速率增大
难度: 困难查看答案及解析
-
下列说法不正确的是
A.明矾净水的原理是Al3+水解产生Al(OH)3胶体,Al(OH)3胶体能吸附水中的悬浮杂质,并使之沉降
B.摩尔盐的制备原理为:6H2O+FeSO4+(NH4)2SO4=(NH4)2Fe(SO4)•6H2O,反应之所以能进行的原因是(NH4)2Fe(SO4)•6H2O溶解度最小
C.镀锌铁皮在酸中溶解,当镀层反应完全时,产生氢气的速率会突然减慢
D.将火柴头直接浸入品红溶液中,可以检验火柴头中是否含有硫元素
难度: 困难查看答案及解析
-
关于海带中提取碘实验,下列说法正确的是
A.实验中包含溶解、过滤、升华等步骤
B.加入过量的氯水将I-全部氧化成I2
C.可以用CCl4直接将海带中的碘元素萃取出来
D.将海带灼烧的目的是除掉其中的有机物,将碘元素转化为I-
难度: 困难查看答案及解析
-
若将反应:Zn+H2SO4= ZnSO4+H2↑设计成原电池(装置如右),
则下列说法正确的是
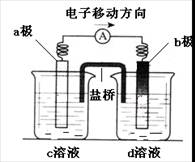
A.d溶液是稀硫酸
B.c溶液颜色变蓝
C.b极发生氧化反应
D.a极是铜棒
难度: 困难查看答案及解析
-
在密闭容器中充入0.5mol N2和1.5mol H2发生反应:N2(g)+3H2(g)
2NH3(g)ΔH =-92.4 kJ•mol-1,充分反应后放出的热量为
A.等于92.4kJ B.等于46.2kJ C.大于46.2kJ D.小于46.2kJ
难度: 困难查看答案及解析
-
在2SO2(g)+O2(g)
2SO3(g) 的平衡体系中,当分离出SO3时,下列说法中正确的是
A.正反应速率增大 B.平衡向逆反应方向移动
C.正反应速率大于逆反应速率 D.逆反应速率一直减小
难度: 困难查看答案及解析
-
下列离子方程式错误的是
A.氢氧化铝溶解在强碱中:Al(OH)3+OH-=Al(OH)4-
B.苯酚钠溶液中通入少量二氧化碳:C6H5ONa+H2O+CO2 C6H5OH+NaHCO3
C.亚硝酸钠与氯化亚铁的反应:NO2-+2H++Fe2+ = Fe3++NO↑+H2O
D.纸层析实验中铜离子与氨水的显色反应原理:Cu2++2NH3·H2O = Cu(OH)2↓+2 NH4+
难度: 困难查看答案及解析
-
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如下图所示。下列说法不正确的是
A.在0点时,醋酸不导电
B.a、b、c三点,a点时醋酸溶液中H+浓度最小
C.b点时,醋酸电离程度最大
D.可通过微热的方法使c点溶液中c(CH3COO-)增大
难度: 困难查看答案及解析
-
下列各溶液中,相关微粒物质的量浓度关系不正确的是高
A.0.1 mol·L-1NH3•H2O溶液中: c (NH4+) < c (OH-)
B.0.1 mol·L-1 NH4Cl溶液中:c(NH4+)+c(H+)=c(Cl-)+c(OH-)
C.0.1 mol·L-1Na2CO3溶液中:c((HCO3-)+c(CO3-)+ c (H2CO3)= 0.1 mol·L-1
D.浓度均为0.1 mol·L-1的NH4Cl、CH3COONH4、NH4HSO4溶液,c(NH4+)大小顺序:CH3COONH4 > NH4Cl > NH4HSO4
难度: 困难查看答案及解析
-
硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,下列各组实验中最先出现浑浊的是:
实验
组别
反应
温度/℃
Na2S2O3溶液
稀H2SO4
H2O
V/mL
c/(mol·L-1)
V/mL
c/(mol·L-1)
V/mL
A
25
5
0.1
10
0.1
5
B
25
5
0.2
5
0.2
10
C
35
5
0.1
10
0.1
5
D
35
5
0.2
5
0.2
10
难度: 困难查看答案及解析
-
在恒容密闭容器中存在下列平衡:C(s)+H2O(g)
CO(g)+H2(g)。CO(g)的平衡物质的量浓度c(CO)与温度T的关系如右图所示。下列说法错误的是
A.该反应的ΔH>0
B.若T1、T2时的平衡常数分别为K1、K2,则K1=K2
C.通过加热可以使B点变到C点
D.在T2时若反应进行到状态D,则一定有υ(正) <υ(逆)
难度: 困难查看答案及解析
-
(10分)CH3COOH是中学化学中常用的一元弱酸,请回答下列问题:
(1)若分别将pH=2的盐酸和醋酸稀释100倍,则稀释后溶液的pH:盐酸▲________醋酸(填“>”、“=”或“<”)。
(2)将100mL 0.1mol·L-1的CH3COOH溶液与50mL 0.2mol·L-1的NaOH溶液混合,所得溶液呈________▲________性,原因▲ (用离子方程式表示)。
(3)已知某混合溶液中只含有CH3COO-、H+、Na+、OH-四种离子,且离子浓度大小关系为:c(CH3COO-)> c(H+)> c(Na+)> c(OH-),则该溶液中含有的溶质为▲ 。
(4)已知Ka(CH3COOH)= 1.76×10-5 ,Ka(HNO2)= 4.6×10-4,若用同浓度的NaOH溶液分别中和等体积且pH相等的CH3COOH和HNO2,则消耗NaOH溶液的体积关系为:前者▲ 后者(填“>,<或=”)
(5)已知25℃时,0.1mol·L-1醋酸溶液的pH约为3,向其中加入少量醋酸钠晶体,发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠呈碱性,所以溶液的pH增大;乙同学给出另外一种不同于甲同学的解释,请你写出乙同学可能的理由________▲________。
难度: 困难查看答案及解析
-
(12分)能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上合成甲醇的反应原理为:CO(g) + 2H2(g)
CH3OH(g) ΔH,
下表所列数据是该反应在不同温度下的化学平衡常数(K)。
温度
250℃
300℃
350℃
K
2.041
0.270
0.012
①根据表中数据可判断ΔH________▲________0 (填“>”、“=”或“<”)。
②在300℃时,将2 mol CO、3 mol H2和2 mol CH3OH充入容积为1L的密闭容器中,此时反应将________▲________。
A.向正方向移动 B.向逆方向移动 C.处于平衡状态 D.无法判断
(2)已知在常温常压下:
①2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(l) ΔH = -1451.6 kJ·mol-1
②2CO (g)+ O2(g) = 2CO2(g) ΔH = -566.0 kJ·mol-1
写出该条件下甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:________▲________。
(3)以甲醇、氧气为原料,KOH溶液作为电解质构成燃料电池总反应为:2CH3OH+3O2+4OH-=2CO32-+6H2O,则负极的电极反应式为________▲________,随着反应的不断进行溶液的pH________▲________(填“增大”“减小”或“不变”)。
(4)如果以该燃料电池为电源,石墨作两极电解饱和食盐水,则该电解过程中阳极的电极反应式为________▲________;如果电解一段时间后NaCl溶液的体积为1L,溶液的pH为12(25℃下测定),则理论上消耗氧气的体积为▲ mL(标况下)。
难度: 困难查看答案及解析
-
(10分)碘钨灯具有使用寿命长、节能环保等优点。一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:
W(s)+ I2(g)
WI2(g)ΔH<0
为模拟上述反应,在450℃时向一体积为2L的恒容密闭容器中加入0.1mol碘单质和足量的钨,2min后反应达到平衡,测得碘蒸气浓度为0.005 mol·L-1。请回答下列问题:
(1)前两分钟内碘蒸气的反应速率为________▲________。
(2)能够说明上述反应已经达到平衡状态的有________▲________。
A.I2与WI2的浓度相等
B.容器内气体压强不再变化
C.W的质量不再变化
D.单位时间内,金属钨消耗的物质的量与碘化钨生成的物质的量相等
E.容器内混合气体的密度保持不变
(3)下图为该反应在450℃时的时间—速率图,则t2时刻改变的外界条件可能是________▲ ________,若t4时刻将容器压缩至一半(各物质状态不变),保持该条件至t6,请在图中画出t4到t6时间段内大致曲线图,并在相应曲线上标上υ3(正)、υ3(逆)
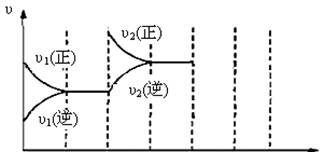
t0 t1 t2 t3 t4 t5 t6 t
(4)假设灯丝温度为660℃,灯泡壁温度为350℃。请根据化学反应原理分析在灯泡内充入碘能够延长钨丝寿命的原因________▲ ________。
难度: 困难查看答案及解析
-
(10分)从今年3月16日下午开始,大陆“海水受日本核辐射污染,碘可防辐射”等消息疯传,从绍兴、宁波、台州地区开始出现抢盐潮,接着蔓延到多个城市,人们抢购加碘盐是因为食盐中添加了碘元素。
I.人们在即将受到核辐射前的24小时内,需在医生指导下服用碘片,成人推荐服用量为100mg碘,假设此碘盐碘元素含量为40 mg/kg,要达到上述碘含量要求,需服用该碘盐________▲________kg,你觉得服用碘盐防辐射合理吗?▲________
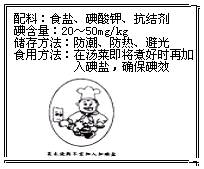 II.右图为某加碘盐标签的一部分。
II.右图为某加碘盐标签的一部分。已知:①KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
②I2+2Na2S2O3=2NaI+Na2S4O6(无色)
某同学欲测定此加碘盐中碘元素的含量,进行以
下实验:
步骤1:称取ag市售食盐,配成溶液,全部转移
至锥形瓶中,加入适量新制KI溶液,滴入几滴稀硫酸,溶液变黄色,再加入3滴淀粉溶液。
步骤2:取一支50mL碱式滴定管,用bmol·L-1的新制Na2S2O3 溶液润洗2~3次后,装满溶液,调节液面高度至0刻度。
步骤3:开始滴定直至终点,重复操作2~3次,实验数据记录如下:
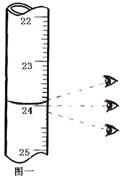
编号
碱式滴定管读数
消耗体积(mL)
滴定前刻度
滴定后刻度
1
0
如图一
2
0
23.98
23.98
3
0
24.02
24.02
(1)第一次读数为________▲________mL。
(2)滴定终点的判断方法▲ 。
(3)经过计算,此加碘盐碘元素的含量为▲ mg/kg(用包含a、b的最简表达式表示)。
(4)下列操作可能会导致测量结果偏低的是________▲________。
A.步骤1中称取食盐时将砝码放在左盘,食盐放在放在右盘,游码读数为0.5g
B.步骤1所配食盐溶液未完全转移至锥形瓶
C.步骤2中滴定管洗涤后未润洗
D.步骤3滴定前滴定管尖嘴处有气泡,滴定后气泡消失
难度: 困难查看答案及解析
-
(14分)某研究性学习小组欲利用所学知识制备并提纯硫酸铜。所用原料为废旧铜材(含铁约2%,其它杂质忽略不计),过程如下:
I:制备硫酸铜
装置如右图,写出阳极发生的电极反应式________▲________、
________▲________。
II:提纯硫酸铜
待反应结束后,取出电极,按照如下流程提纯得到硫酸铜晶体(CuSO4·5H2O)

已知此溶液中Fe2+、Fe3+、Cu2+形成氢氧化物的pH如下表
离子
开始沉淀的pH
完全沉淀的pH
Fe2+
6.4
8.4
Fe3+
2.4
3.1
Cu2+
5.2
6.5
(1)写出步骤①发生反应的离子方程式________▲________。
(2)步骤②中可加入________▲________(填化学式)调节溶液pH至________▲________(填范围)。
(3)步骤③不能蒸干的原因是________▲________。

(4)右图表示硫酸铜晶体在乙醇水混合溶剂中溶解度随乙醇体积分数的变化曲线,则最适合作为步骤⑥洗涤液是________▲________。
A.无水乙醇 B.蒸馏水
C.95%乙醇溶液 D.饱和硫酸钠溶液
(5)操作1的名称是________▲________。
难度: 困难查看答案及解析